细胞培养
- 超净工作台:保护材料不受污染,风往外吹;生物安全柜:保护实验者不受污染,风往内吸。
- 细胞转染【转到动物细胞】和转化【转到细菌、植物细胞等系统】

神经网络的构建
- 透明化:固定相的形态结构——适合所有对象
- iDISCO:替换脑组织的脂质——看神经纤维的投射
- CLARITY:水凝胶替代脂质
- HYBRiD:化学去除脂质+水凝胶【可进行原位杂交】
- Labeling:免疫染色、免疫组化【用标记的特异性抗体(或抗原)对组织内抗原(或抗体)的分布进行组织和细胞检测技术。】
- 注:自发荧光——看光谱是否和成像荧光分开、荧光寿命可进行区分【自发荧光荧光寿命长】
- Fret:需要做共振转移产生的光和原来荧光的ratio
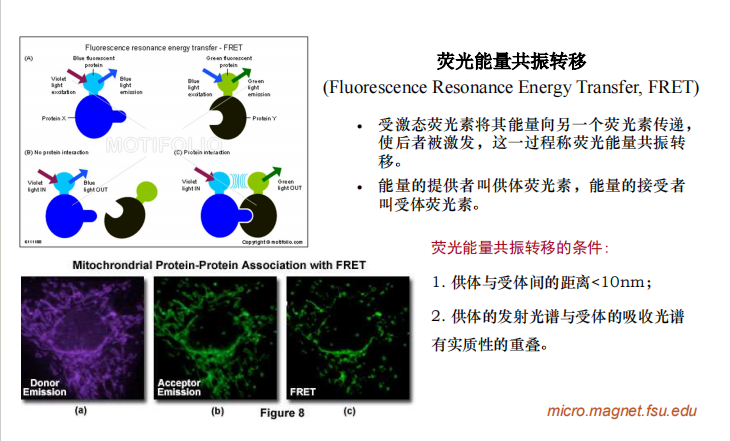
- In situ hybridization(原位杂交):观察局部转录的变化情况——RNA的动态分布

- Sparse labeling:稀疏标记 ^d8afa3
- 基因枪法
- 遗传手段:二元表达系统【MARCM:FLP的随机重组,导致神经元随机且少量被标记】
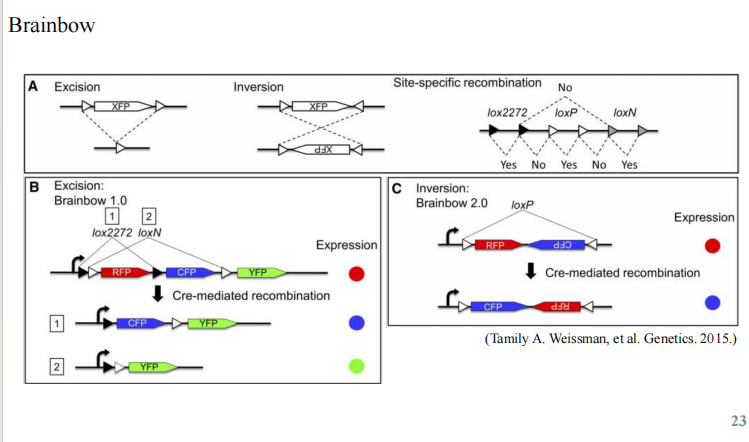
- Brainbow:UAS-GAL4【温度升高导致Gal80失活,GAl4诱导cre的表达】;荧光发育早期热激【神经母细胞】——cre进行随机切割产生随机颜色【双拷贝——避免重复颜色、亦或者单拷贝进行大量果蝇的对比】;诱导的时机也得把握,否则一个谱系的细胞并不能标记全!
- SPARC:例如——Rxn1/
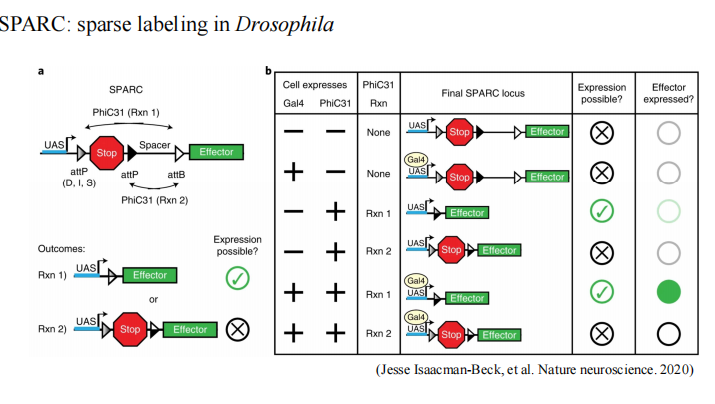 2酶的存在下,随机【存在phiC31+GAL4】减去STOP元件,导致荧光信号或目的基因【effector】的表达
2酶的存在下,随机【存在phiC31+GAL4】减去STOP元件,导致荧光信号或目的基因【effector】的表达
- 突触活动的标记【GRASP】:就是将GFP分割为两个组件,分离的GFP组件不具有发光功能。在两组神经元中分别表达GFP的两个组件,当两组神经元存在突触连接时,GFP的两个组件在突触部位自动结合形成完整的具有功能的GFP,此时突触结构产生绿色荧光。 如果两组神经元不存在突触连接,则不产生荧光。【X-RASP——GFP1-10的突变】
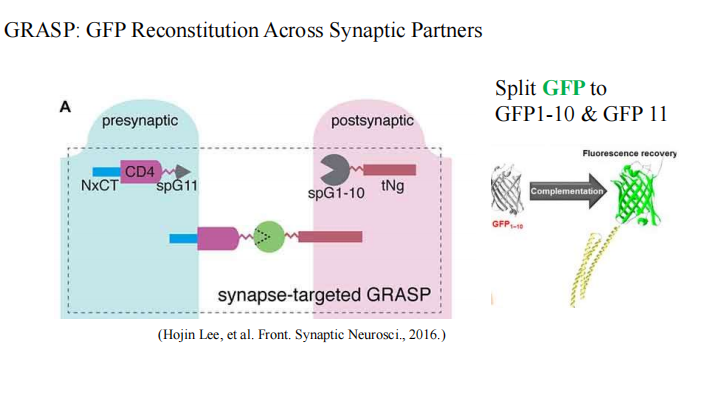
- 突触connection
- GRASP—突触连接
- Up/Downstream:
- 病毒示踪【哺乳动物】

- transTango——追溯下游【果蝇】

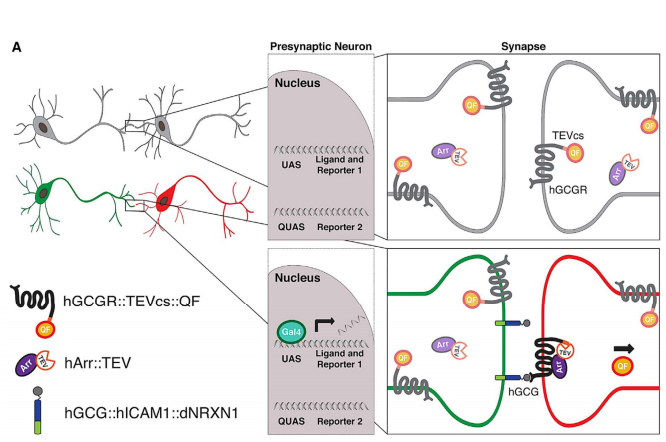 BacTrace——追溯上游神经元
BacTrace——追溯上游神经元
- 思考题:
- 透明化技术在哪些类型的研究中尤为重要?

- 原位杂交方法能否实现稀疏标记?——针对目标序列较少的情况,从优化实验条件和增强信号来实现对这些目标序列较少的地方进行稀疏标记——嵌合体
- 哪些方法适用于研究神经发育谱系?

- Syt-GRASP属于神经联接成像还是神经功能成像方法?

- BacTrace中有几个酶切步骤,分别有什么作用?

信号通路
- 细胞内状态变化:
- 细胞骨架运输:微管运输【EB1-GFP】
- RNA运输:GFP-Lmp
- 囊泡运输:APP-YFP
- 光转化蛋白

- 基于离子浓度变化:
- 钙离子

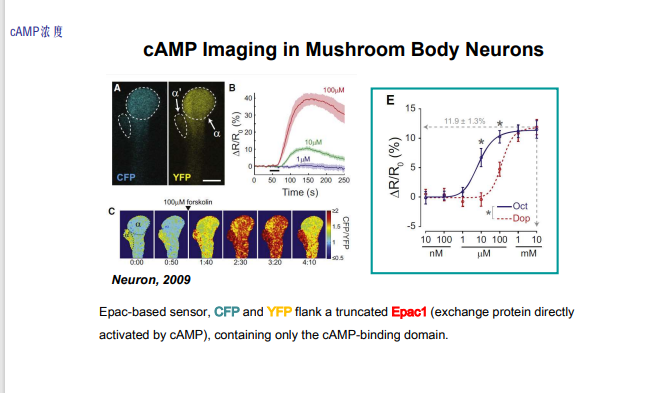
- cAMP
- 标记gap junction:PARIS【神经元加了质子泵,影响第二个神经元H离子浓度的下降(加基于H离子的sensor),从而引发第二个神经元去极化】
- CaMPARI:钙离子浓度越高,亮度越低,因此看ratio——red【PC光照射,光转换——变成红光】/green【神经元不兴奋,钙离子水平低】
- 基于电压的变化 ^fb17ab
- GEVIs:ACE蛋白受电压的变化改变构象,吸收mNeon带来的荧光——FRET效应不发生,荧光变弱【信号的角度:3%的变化要看得到需要基线很稳(如波动0.1%)】
- 受体构型变化:GRAB【GPCR与特殊神经递质结合的构象改变——荧光变亮】
- 基于酶活变化:信号通路的sensor【不同酶带不同repoter】
- 基于蛋白表达:CaLexA【基于钙的内流,钙调蛋白与转录因子(LexA)结合入核,进行报告蛋白的表达】;Trango【找下游神经元】
- 问题:


分子生物学实验
- RNA提取中,总的RNA条带包含什么?

- RNA分离实验最大敌人是什么?

- 最后获得的样品里都有什么RNA?

- 特异靶向神经元的方法:
- DIO系统
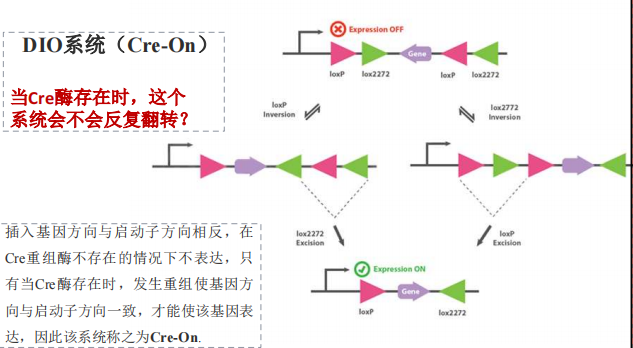 注:一般不会反复翻转,除非有多个loxp位点
注:一般不会反复翻转,除非有多个loxp位点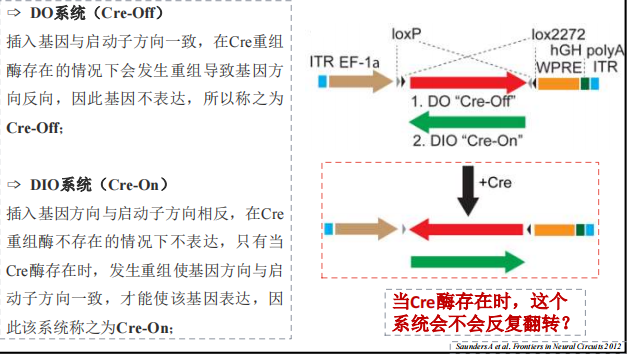
- FLP系统:LOXP——FRT

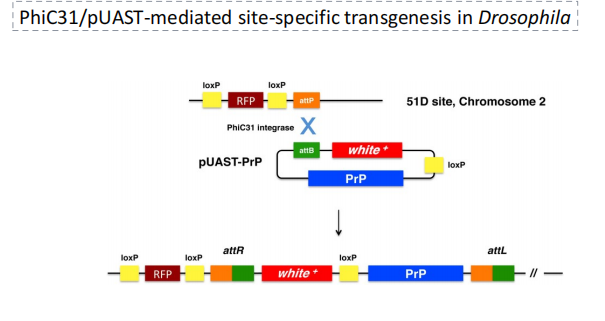
- 转基因果蝇:常用质粒【pUAST——attB同源重组臂,与attP发生重组,即当目标基因的载体DNA带有attP位点时,与宿主细菌中的attB位点可以发生特异性的 DNA重组反应 ,将目标基因插入到宿主细菌染色体的特定位置,从而实现基因的整合】
- WB:蛋白质SDS电泳时带正/负电?

神经系统的操控
- 物理损毁:前脑叶白质切除术——控制疾病、胼胝体切开术——癫痫、双光子激光切断投射纤维——切一侧保留一侧,对比分析纤维功能
- 药物、生化手段【可逆、操作性更强】
- HU【羟基脲】:阻止DNA合成,杀死正在分裂的细胞——果蝇磨菇体嗅觉学习记忆的研究【学习记忆的脑区】
- 蛋白表达:hid/rpr【表达凋亡的基因】
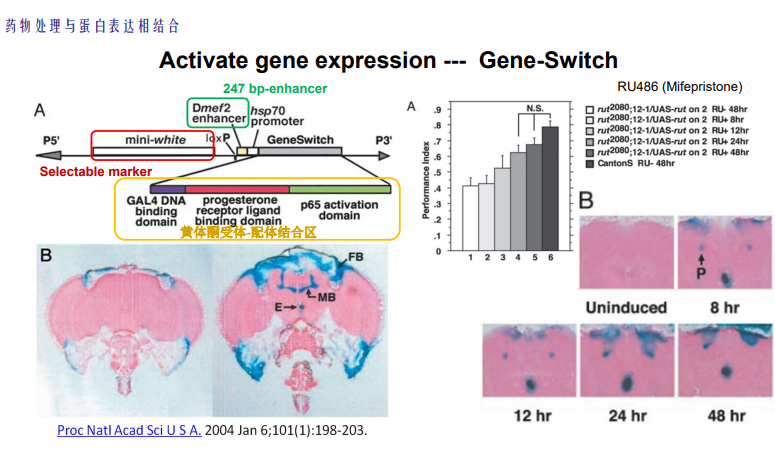
- 药物处理与蛋白表达相结合——表达时间的可控
- DREADD:CNO——调控cre+的神经元
- hM3Dq
- hM4Di
- 神经元受体的判别:加激动剂或者拮抗剂来判别类型
- 温度诱导元件:
- Heat Shock:温度升高激活表达——在改元件后加自己想表达的基因
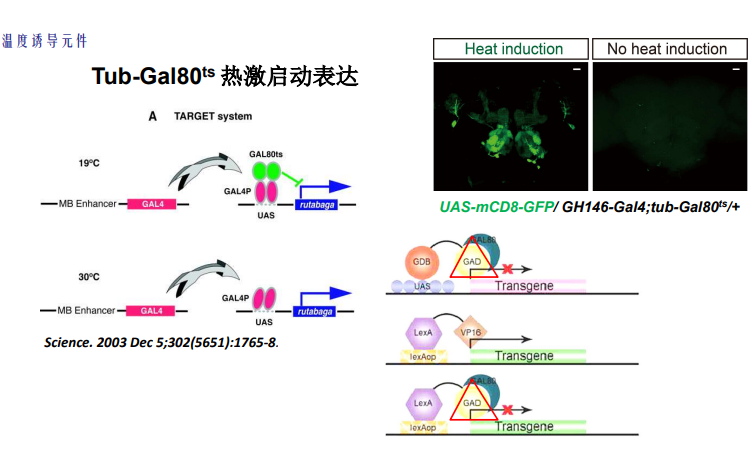
- Tub-Gal80^ts:Gal80阻止Gal4激活下游表达,温度升高80失活
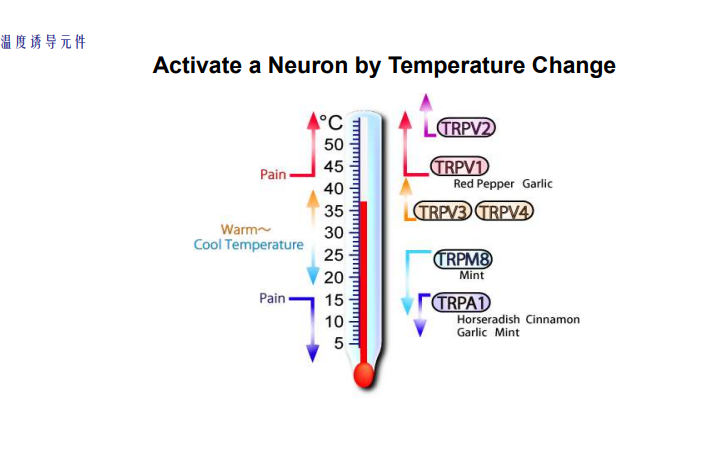
- TRP家族:温度调节开放TRP离子通道进而调控神经元活性
 1.2.3-文献1:双色激发——同时分别激发两群神经元
1.2.3-文献1:双色激发——同时分别激发两群神经元
- 样本量太小——暂时可能无法有把握确定显著性
- 双色激发原理:Chrimson【红光】 、Chronos【蓝绿光】——二者激发光波长可不相交
- Cre-on、Cre-off来控制有cre【遗传学手段特定启动子来使得特异性神经元表达cre】的和没cre的表达情况,只表达一个
1.2.3-文献2:光遗传Protocol
- Step1:体内+体外【光学+行为】——激活神经元的方案设计【设计激活顺序,以及激活方案(空间光调制器SLM,调制光学信号的图案映射)、调节激活强度】
- Step2:手术进行检测蛋白的表达——光控通道蛋白耦合荧光蛋白【表达策略:病毒注射 or 转基因(promoter+cell line)】
- Step3: 荧光显微镜检测蛋白的表达,保证Gcamp和光敏感通道蛋白同时表达
- Step4:设计行为学范式【行为具有可重复性、排除不相关的外界刺激、保证训练的时间和表达蛋白的时间窗口是一致的】
- Step5:利用不同刺激发现行为相关神经元【低分辨率找脑区、高分辨率找感兴趣区域(Suite2p);注意小鼠的运动偏移(偏差大,可能会引起大脑血氧供应发生变化,导致神经元信号出现偏差)】
- step6:光调控行为(看哪些神经元可以被光激活后产生行为)【Naparm:将神经元聚成一组,组激活,看哪些神经元可以被激活;激活方法——双光子点扫描、相位板聚集光束激活目标区域(不能激活太多次,可能直接导致神经元的可塑性,需要确定光照参数)】
- 总结:找行为相关脑区——可以被光激活吗?与行为相关吗?【两类蛋白都要表达】;操控神经元;相似神经元的激活模式是否产生了相似的行为?【注:照射时间不能太长,可能损失神经元或者导致神经元可塑性;要保证小鼠相对显微镜没有发生位移;要保证小鼠时刻处于健康状态】
- 局限性和展望:光学元件需要外源导入【存在细胞毒性,结论不一定可靠】;光激活会加热;激活时小鼠与显微镜可能会发生偏移,需要矫正——更好的软件、硬件、显微镜、成像技术【三光子、电压敏感蛋白的运用、GRIN lens(内窥镜看深层脑区)、自适应光学、光场/光片显微镜的成像】
- 离子通道与囊泡释放
- shibire^ts:阻断囊泡回收,可供释放囊泡变少
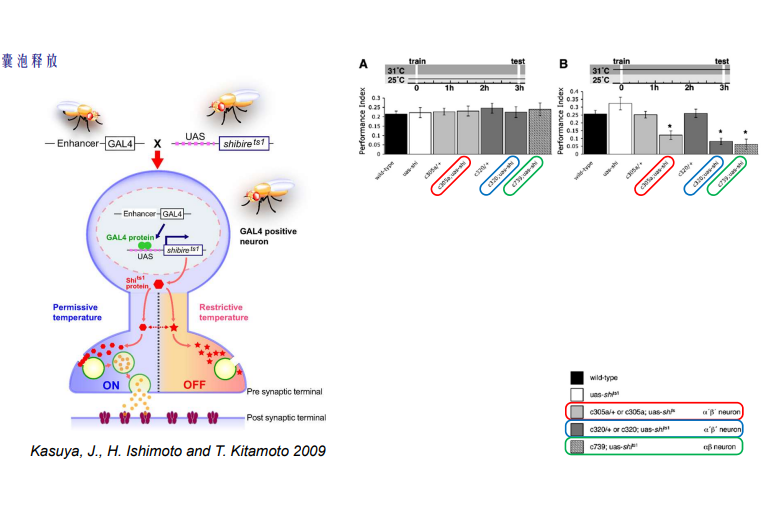 注:其也是一个温度敏感的蛋白,高温时候发生阻断
注:其也是一个温度敏感的蛋白,高温时候发生阻断
- TeTxLCL:药物阻断囊泡释放
- ATP激活P2X2——进而激活神经元
- 光遗传调控:Tau-off(spike衰减到1/e的速度越快越好)+recovery——不应期【30s和1s的信号越一致越好】
- 神经元的光前置——既不能激活也不能抑制【不能响应其他信号】




 2酶的存在下,随机【存在phiC31+GAL4】减去STOP元件,导致荧光信号或目的基因【effector】的表达
2酶的存在下,随机【存在phiC31+GAL4】减去STOP元件,导致荧光信号或目的基因【effector】的表达



 BacTrace——追溯上游神经元
BacTrace——追溯上游神经元











 注:一般不会反复翻转,除非有多个loxp位点
注:一般不会反复翻转,除非有多个loxp位点





 1.2.3-文献1:双色激发——同时分别激发两群神经元
1.2.3-文献1:双色激发——同时分别激发两群神经元 注:其也是一个温度敏感的蛋白,高温时候发生阻断
注:其也是一个温度敏感的蛋白,高温时候发生阻断