图像分析
——重点学习到了图像分析的相关软件以及软件的操作方法
- 相关软件:
- Imagej:
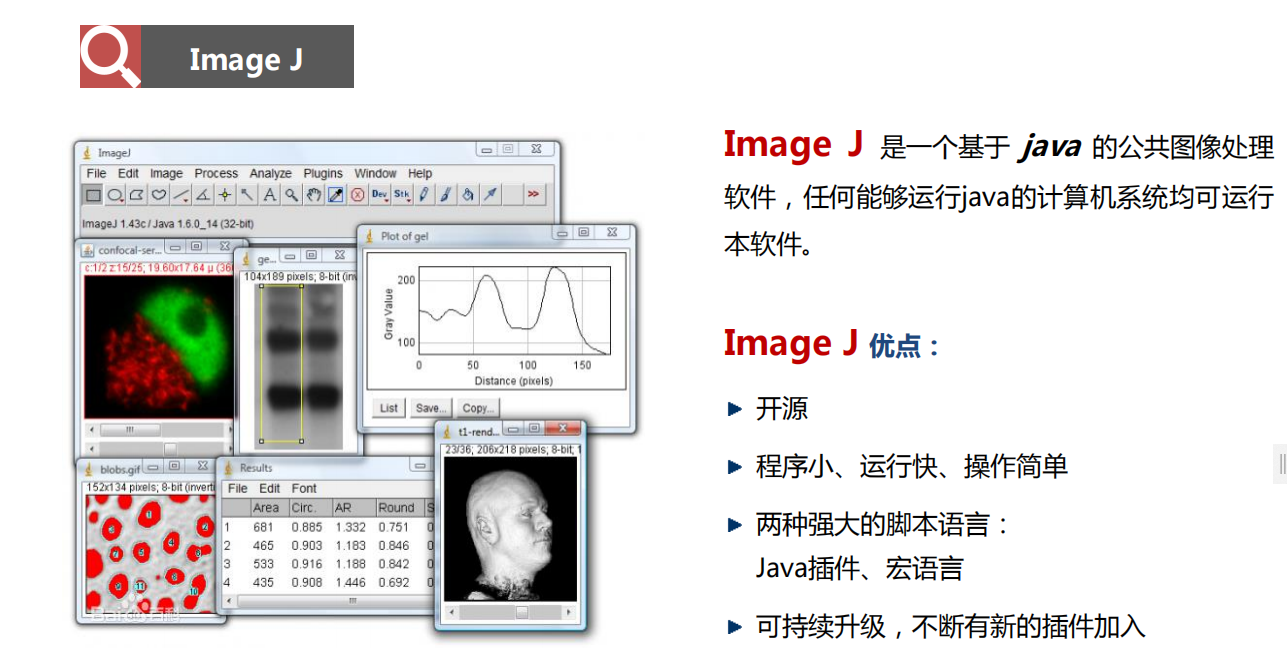
- Imaris:可用于2D到5D显微图像渲染、重构、统计分析的软件,它包含了丰富的测量工具,是世界顶级的图像分析软件之一。优点是其含丰富多样的图像渲染模式及目标导向的各类分析模块,可快速便捷地实现细胞器识别、动态追踪、神经类结构分析,以及进行相应数据统计。(官网: imaris.oxinst.com )
- Amira:是一款功能强大的用于三维可视化展示、图像分割处理与量化分析的软件,专注于电镜、CT、核磁共振图像分析,也用于做荧光图像处理。(官网: thermofisher.com/amira-avizo )


- 反卷积软件:

- CellSens:CellSens Dimension软件具有丰富的图像分析和测量功能。另外,极具特色的TruAI深度学习模块,可针对低衬度、复杂背景下的目标形态进行智能识别。
- Cellpose:基于深度学习的细胞分割开源软件,适合分割的不止是细胞,还有其他可以看作cell的信号。(官网: https://www.cellpose.org/ )
- 其他:

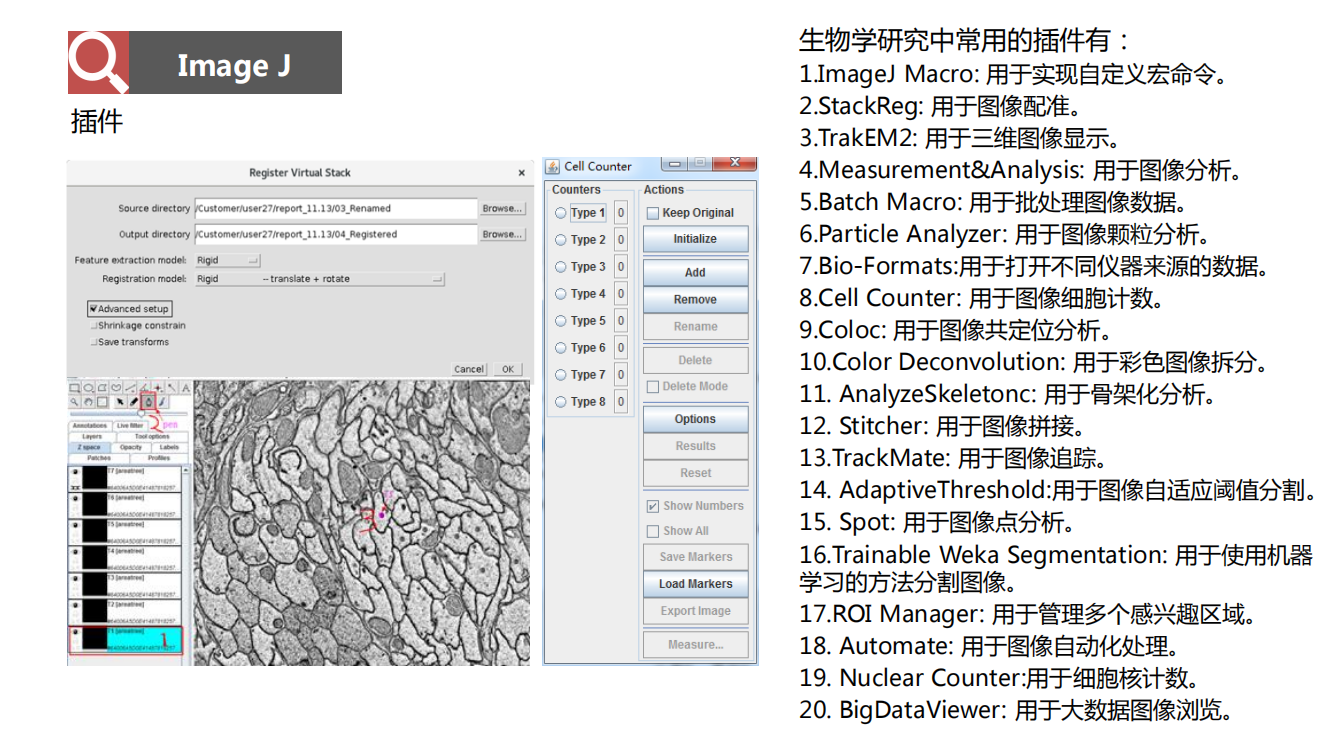
- Imagej:
- 应用案例:
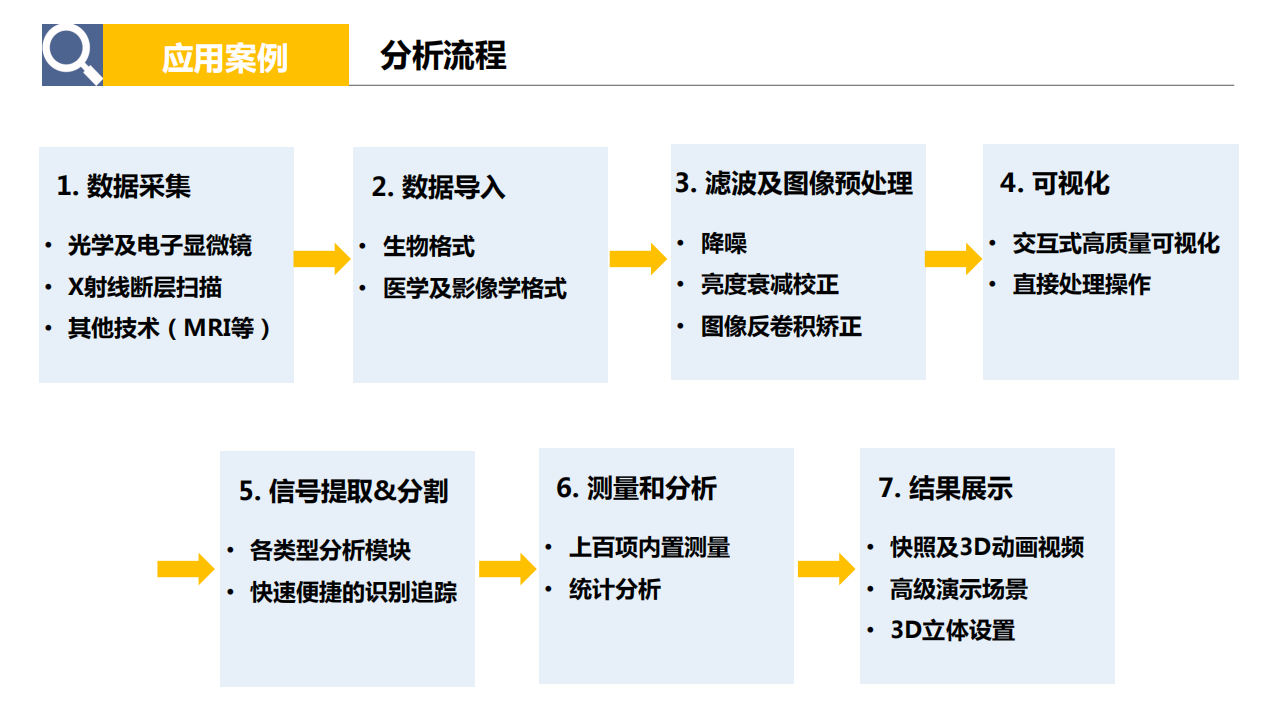
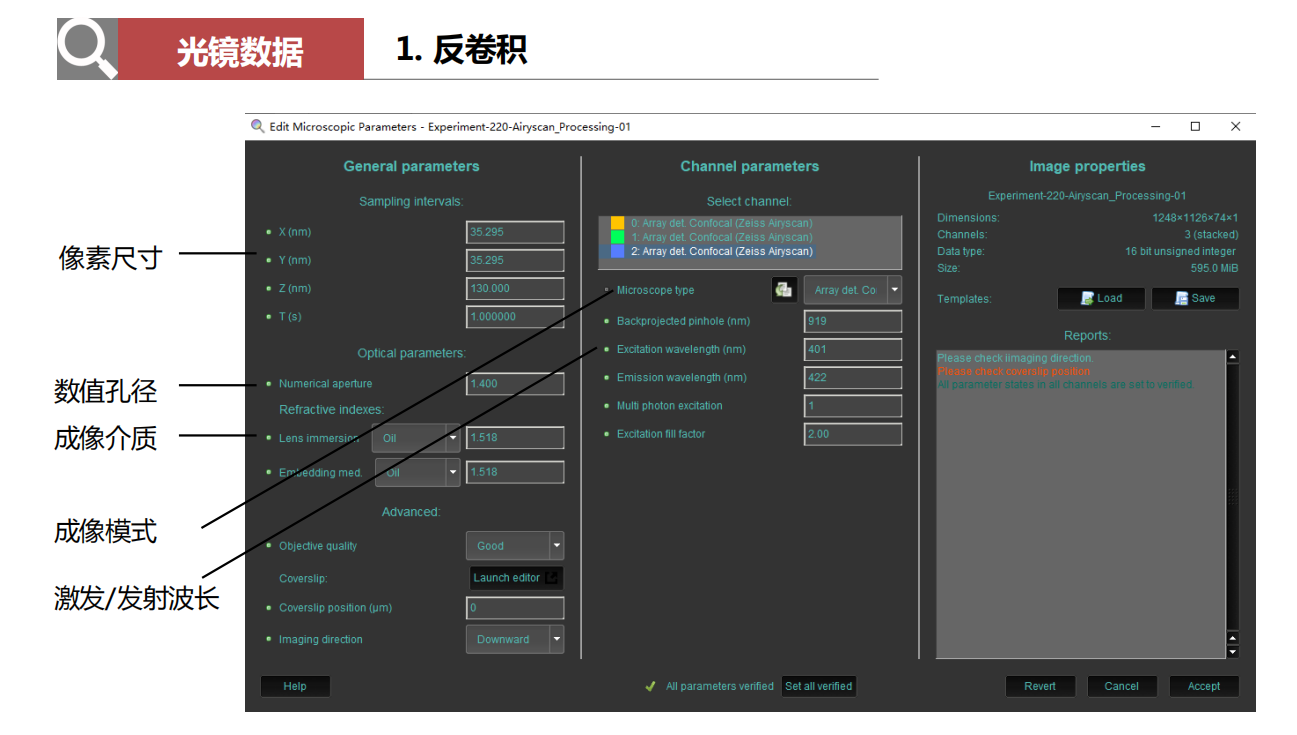
- 光镜数据:图像反卷积、大视野拼图、信号提取,计数、距离、荧光强度等参数测量、神经分析、共定位分析、多对象动态追踪。
- 反卷积:
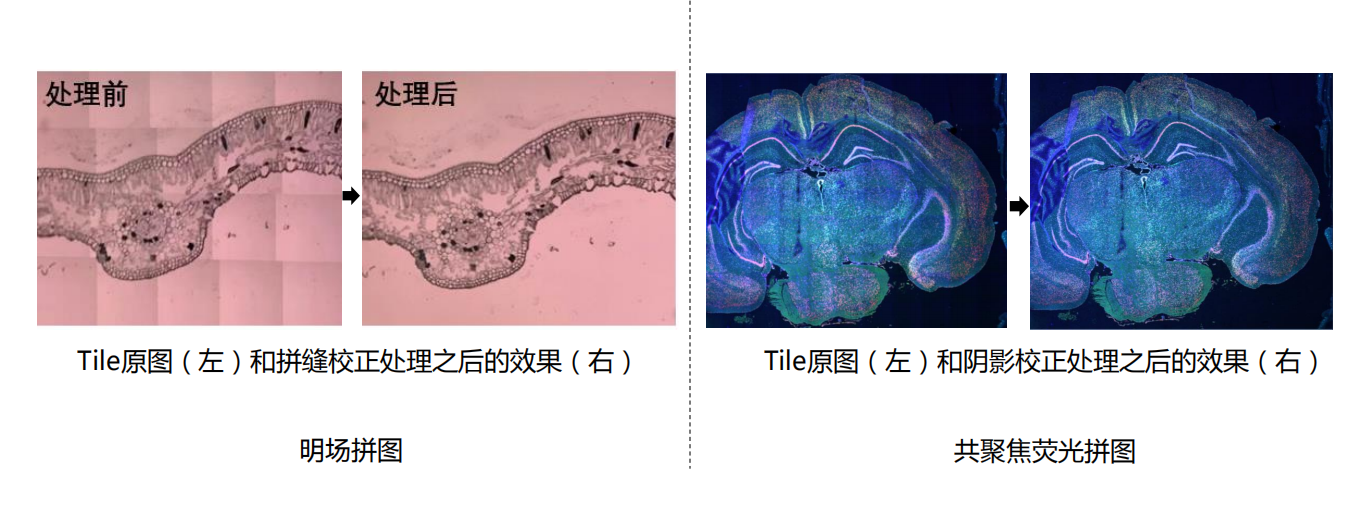
- 大尺度拼图:每一部分的分辨率都很高!
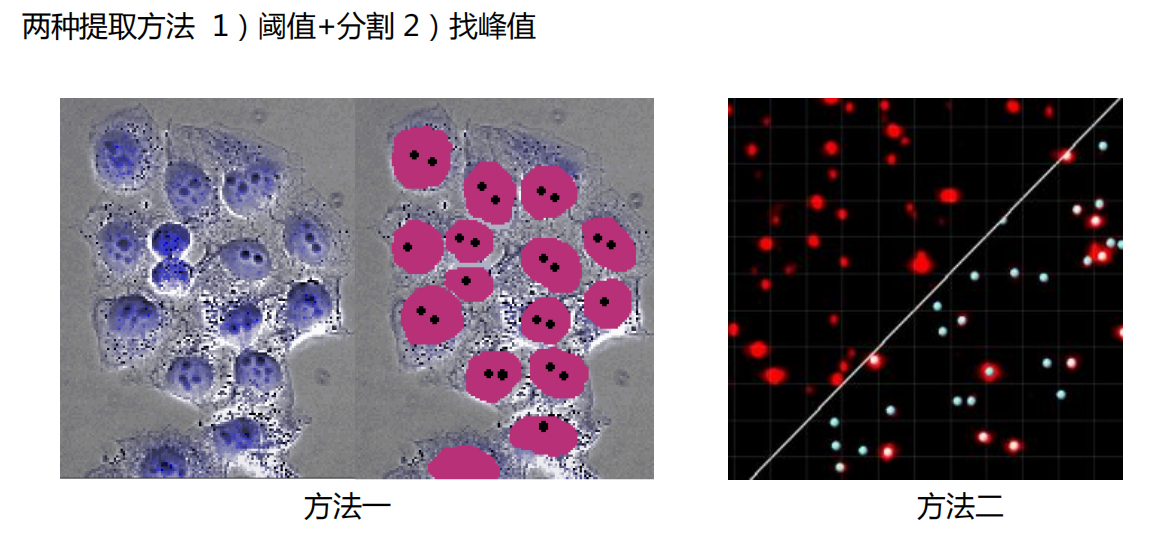
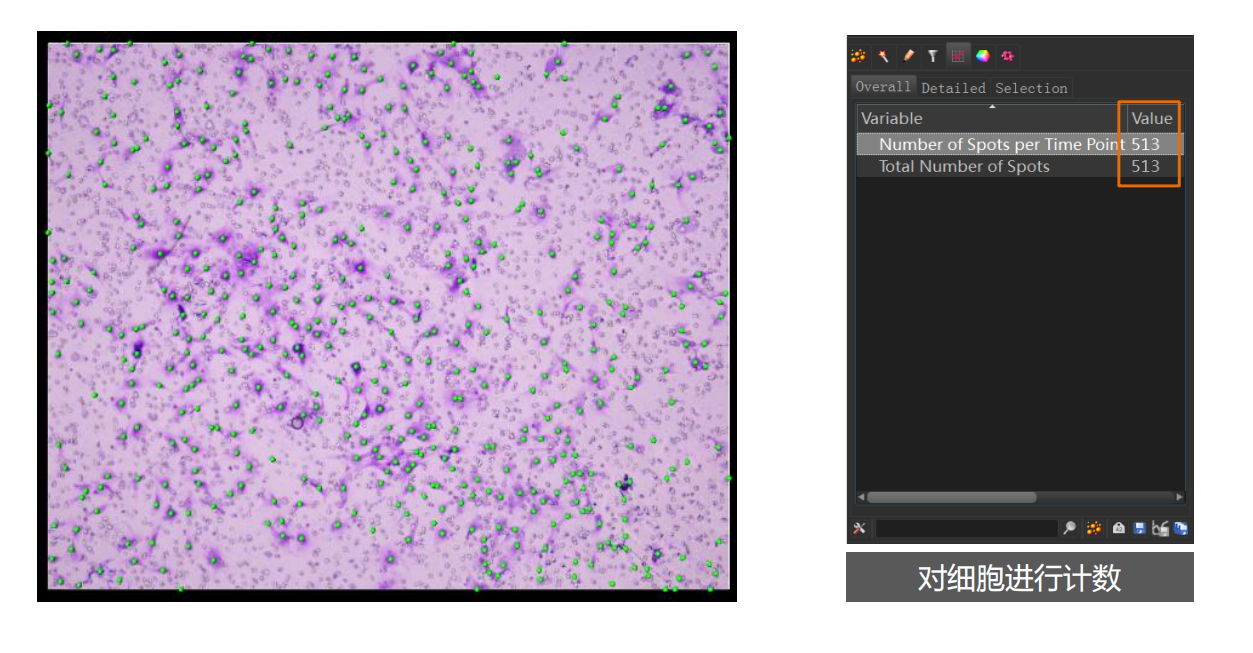
- 点信号提取:定位、计数、测距离:
-
- 面/体信号提取:结构展示、测形态、体积、距离、荧光强度等
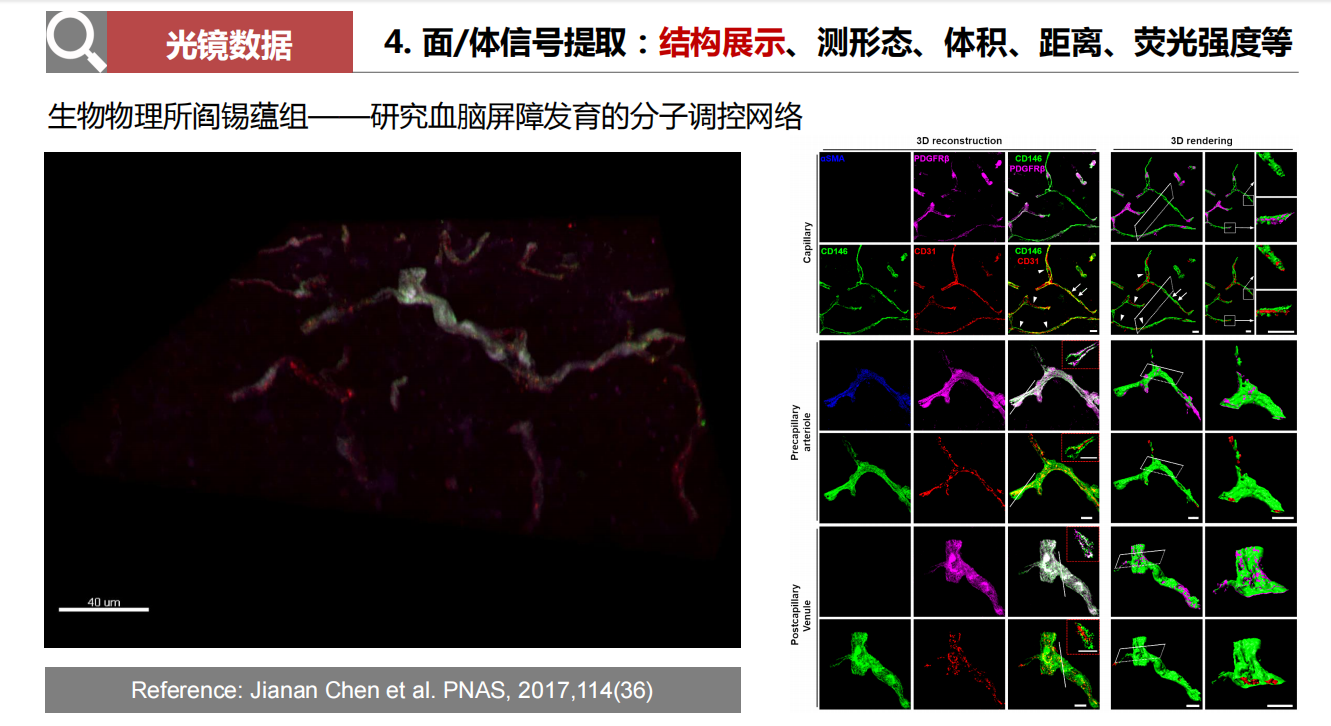
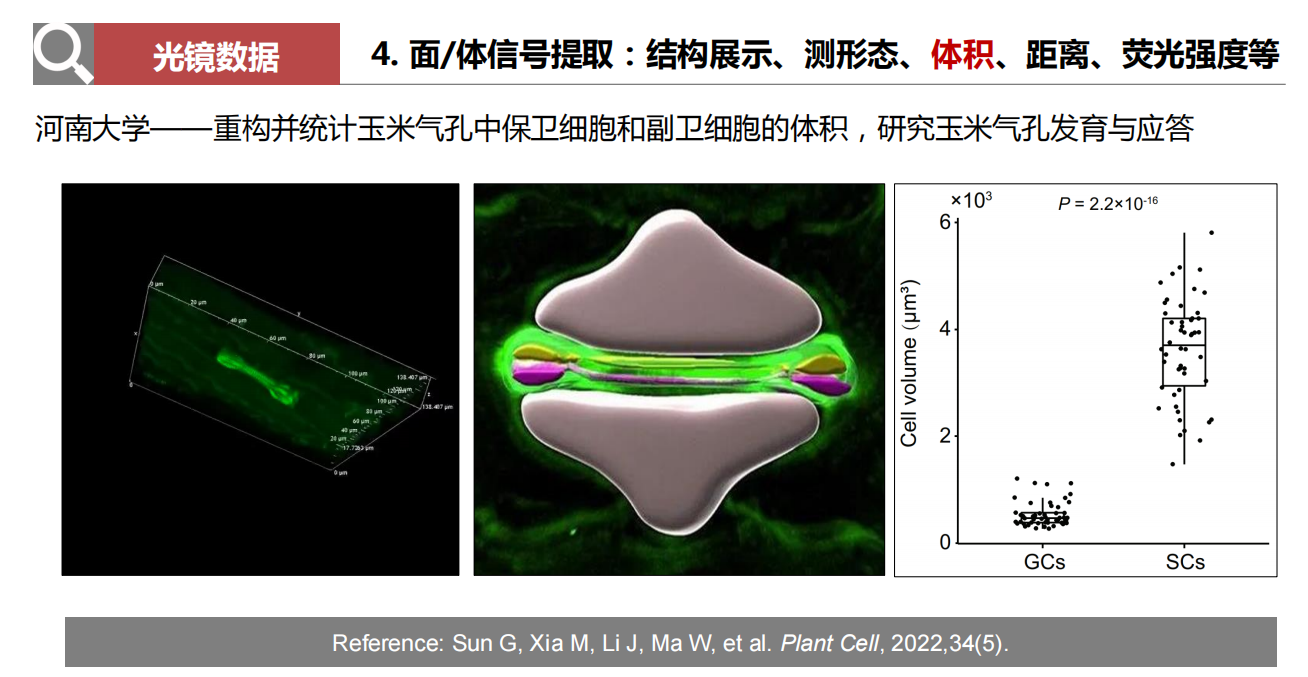
- 面/体信号提取:结构展示、测形态、体积、距离、荧光强度等
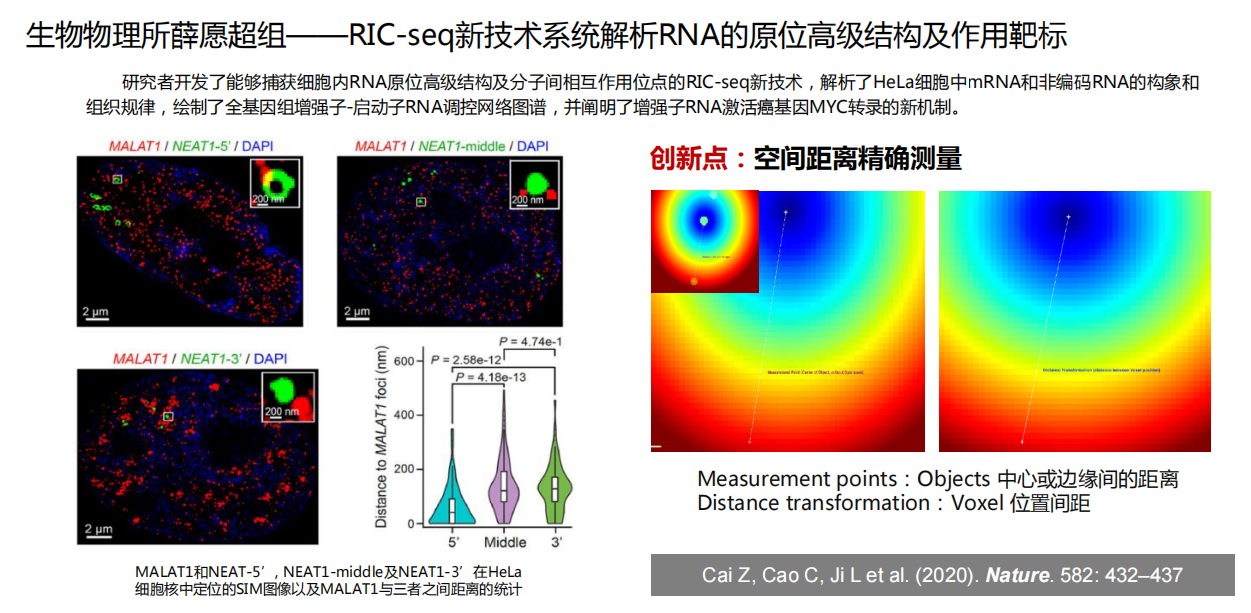
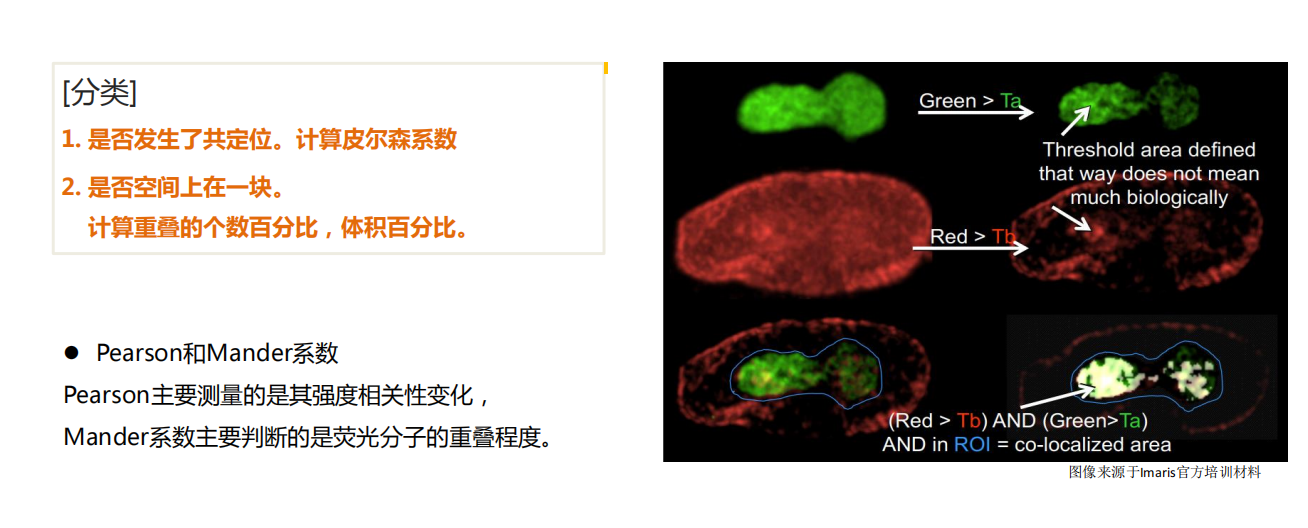
- 共定位分析:如分析RNA与RNA结合蛋白的共定位、量化小鼠精子头尾连接处两种信号的共定位

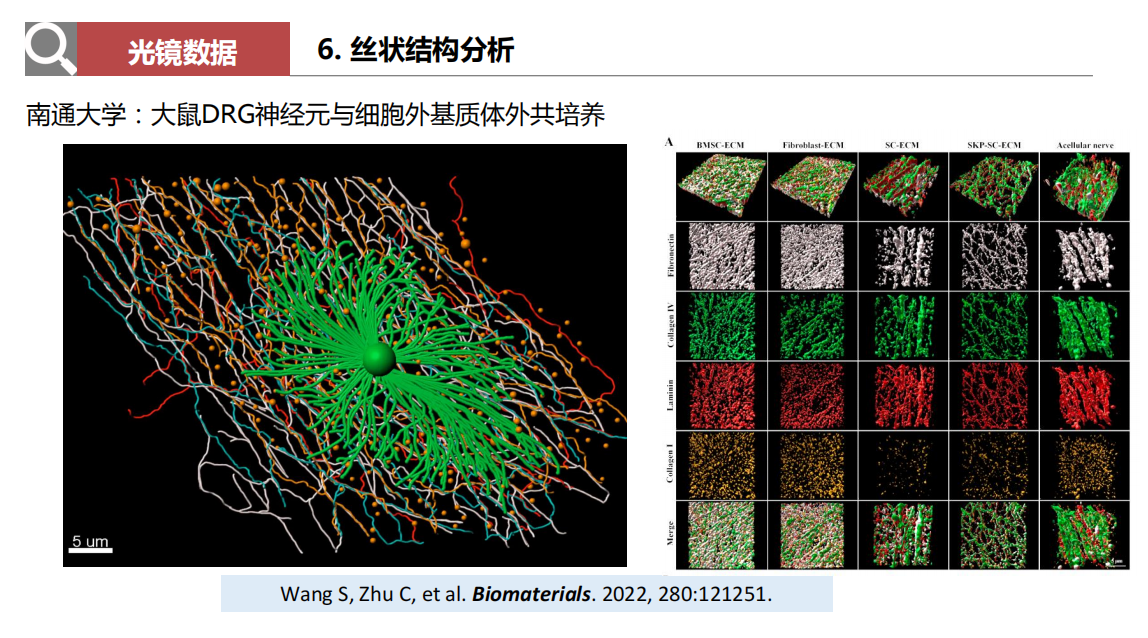
- 丝状结构分析:主要运用于神经生物学领域,如神经走向追踪
- 动态追踪:如分析纳米颗粒在某种胶里的运动快慢、探测气孔周围某物质的向心或离心运动、相分离
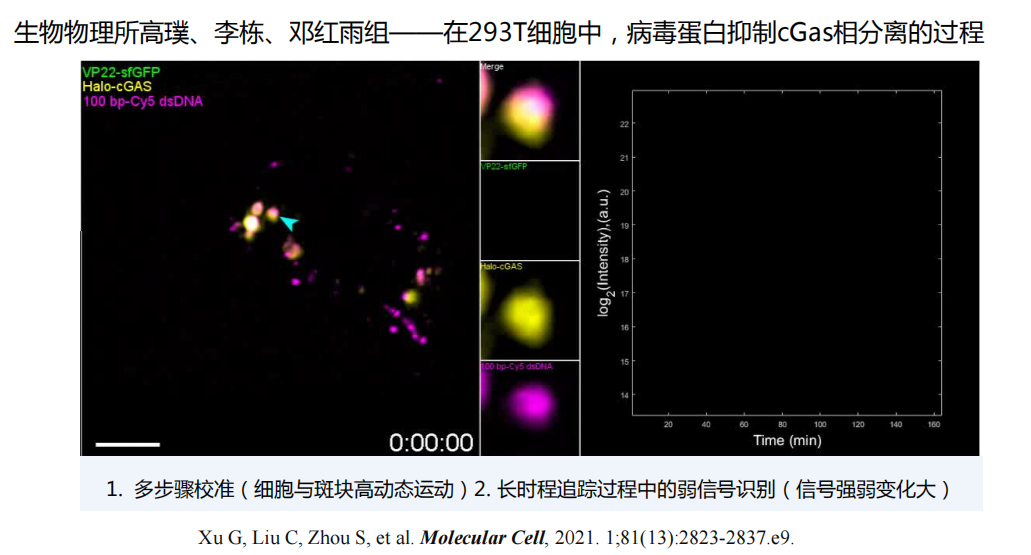
- 反卷积:
- 电镜:大尺度拼接、数据对齐、三维重构、渲染与统计分析、AI结构识别
- 三维重构:
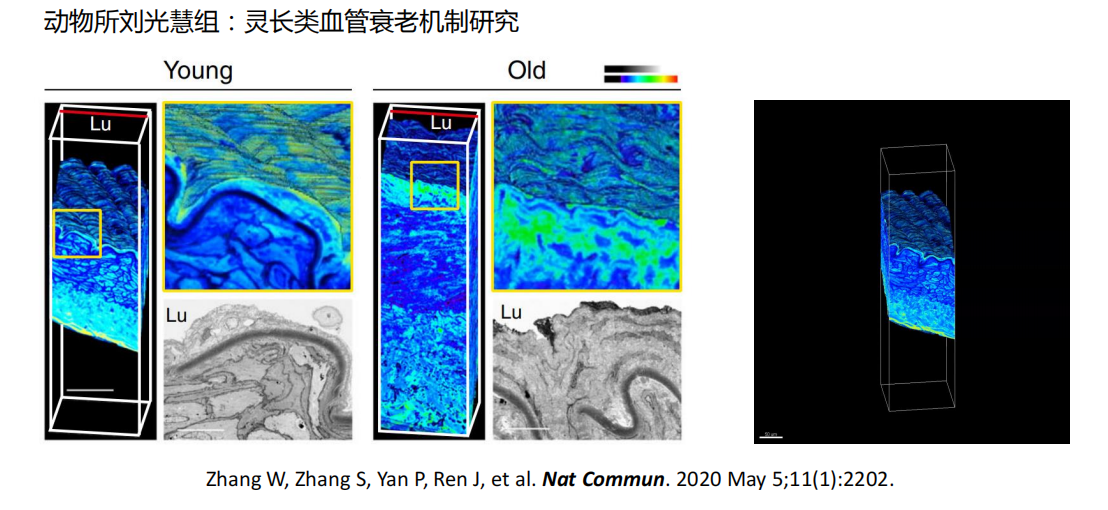
- 三维结构渲染与统计分析:体积、孔隙率

- 利用AI功能自动识别结构:机器学习的运用
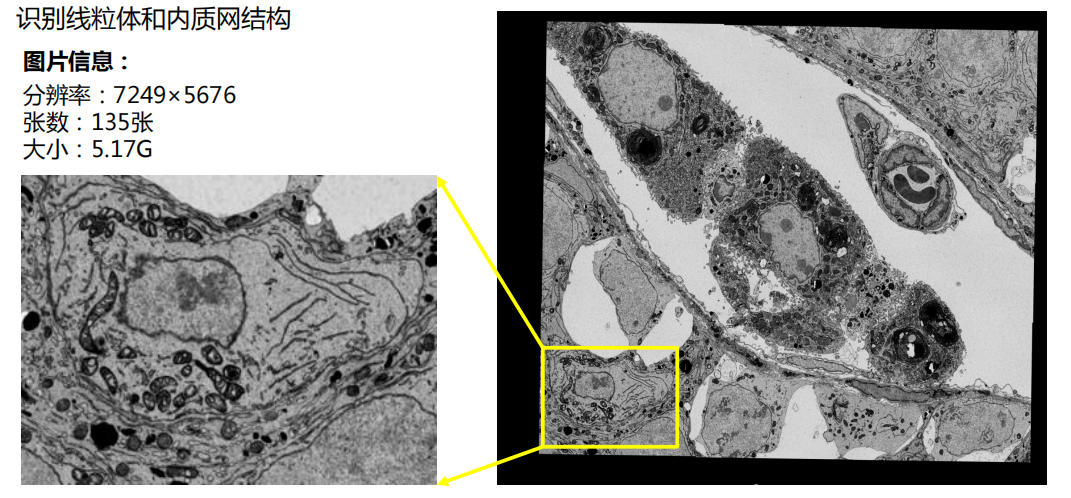
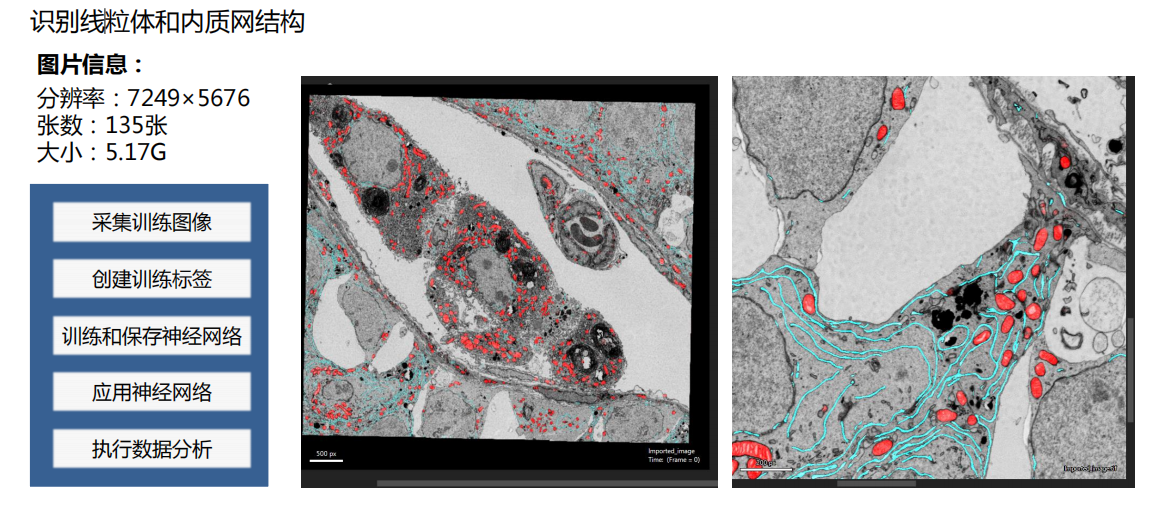
- 三维重构:
- 其他类型数据:Micro-CT、光声显微镜数的信号提取与渲染分析
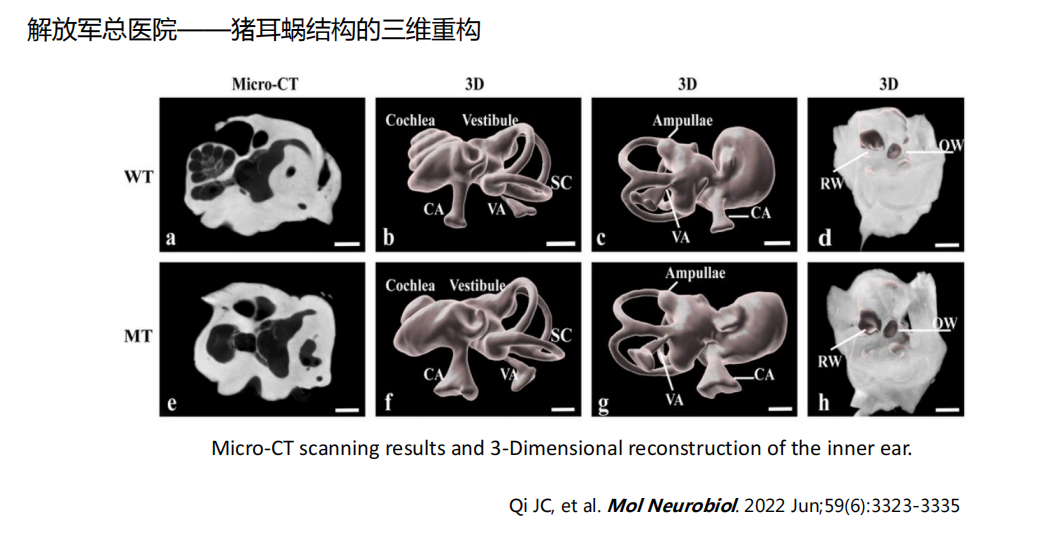
- MicroCT数据:(关于Micro-CT: 一文读懂显微CT(MicroCT)实验 - 知乎 (zhihu.com))
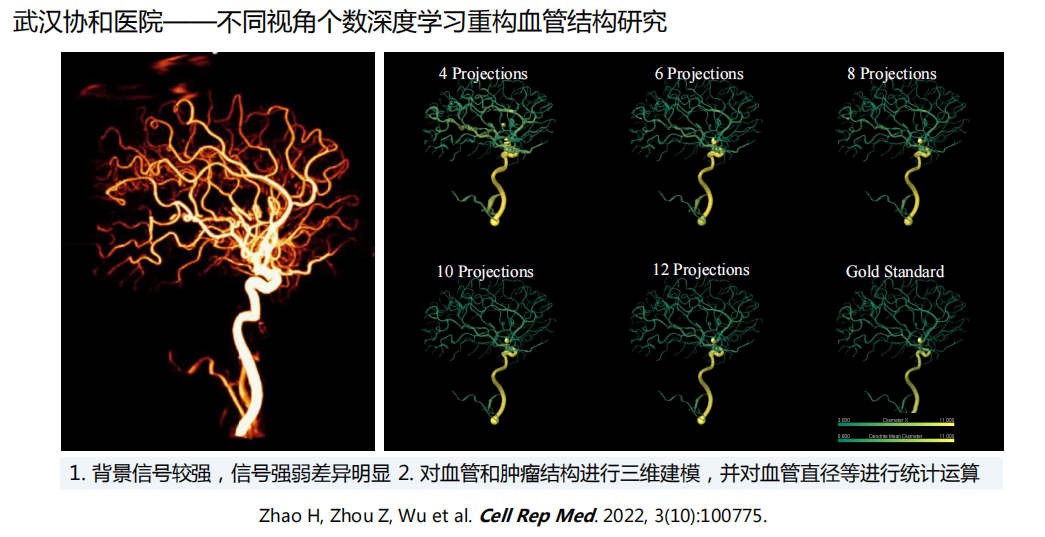
- 光声显微镜数据:(关于光声显微镜:光声成像的基本原理与概念 - 知乎 (zhihu.com))
- MicroCT数据:(关于Micro-CT: 一文读懂显微CT(MicroCT)实验 - 知乎 (zhihu.com))
- 光镜数据:图像反卷积、大视野拼图、信号提取,计数、距离、荧光强度等参数测量、神经分析、共定位分析、多对象动态追踪。
光镜部分
共聚焦——LSM980系统
——操作手册:
1. 开关机: 2. 样品镜检:先调整瞳距,后调焦,调焦时要有耐心(先粗调后细调)。
2. 样品镜检:先调整瞳距,后调焦,调焦时要有耐心(先粗调后细调)。 3. 取图:
3. 取图: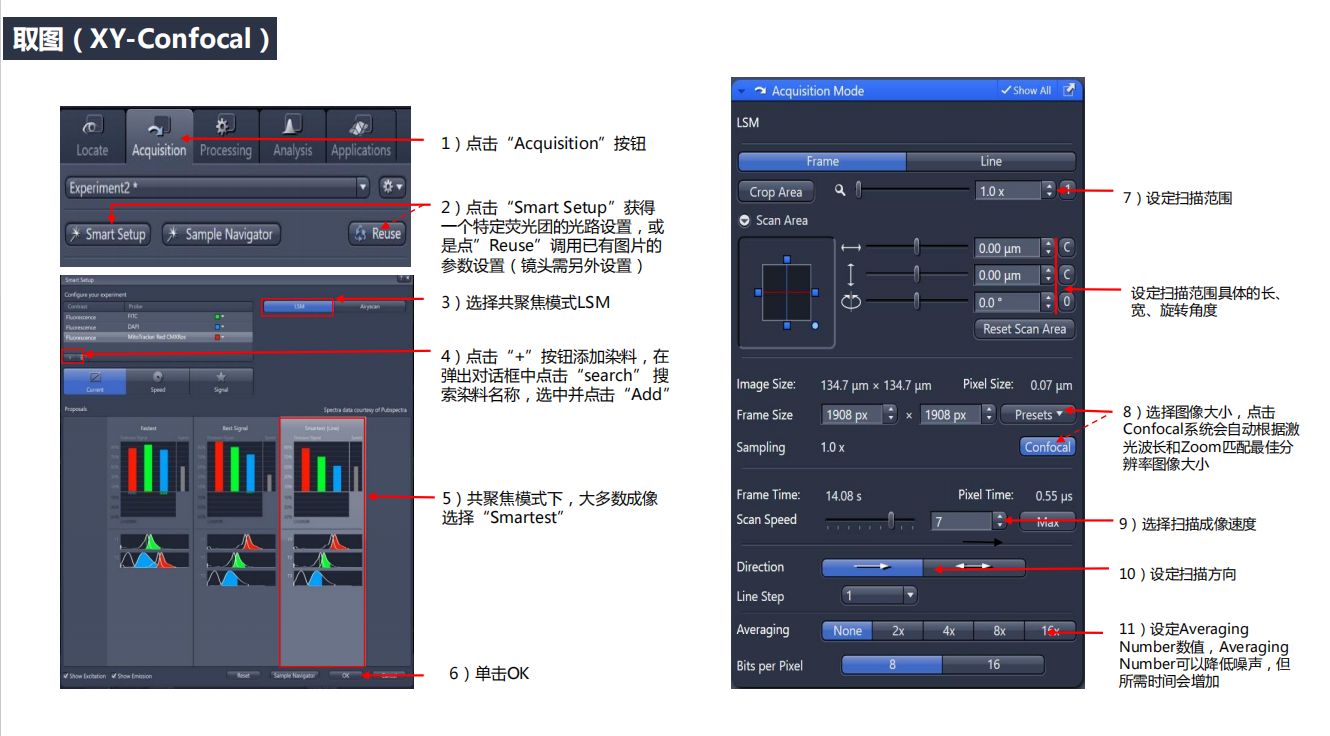
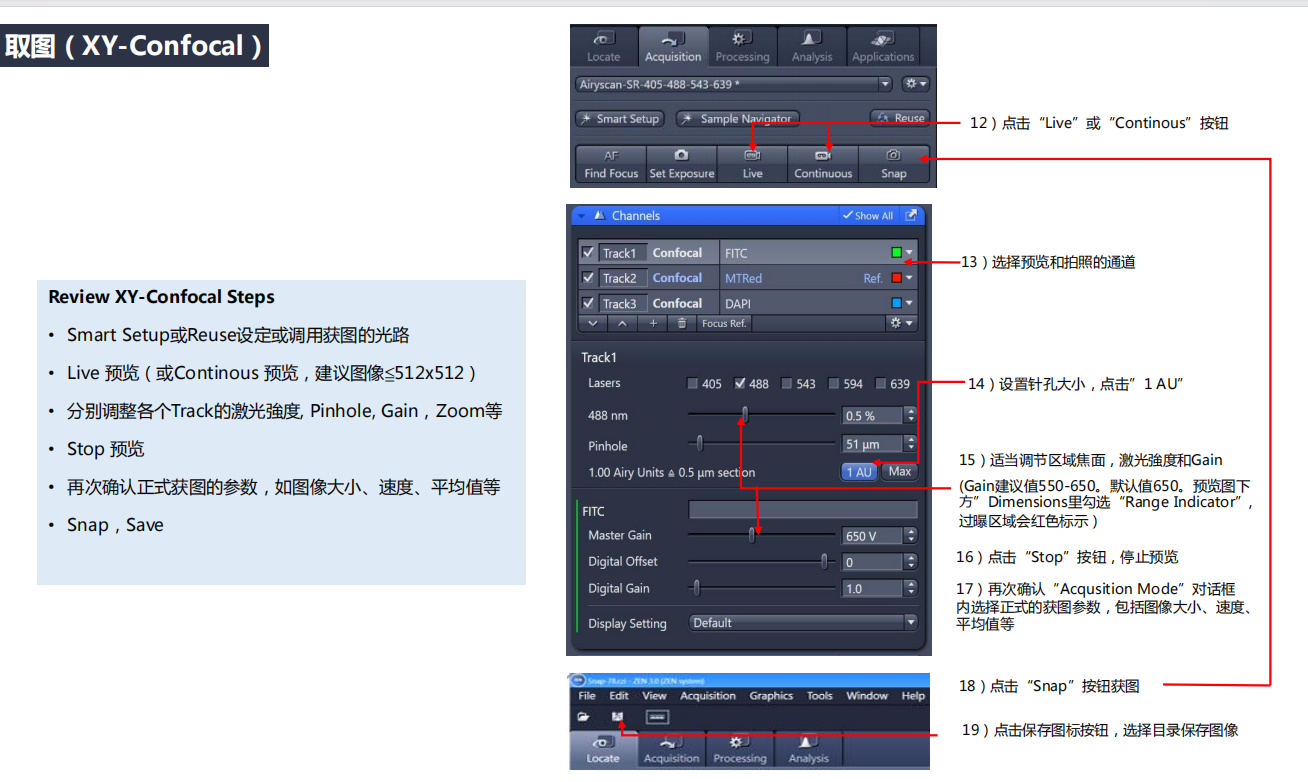 注:关于激光强度——若需要长时间拍照,做live imageing时,强度控制在0.1%以内;若短时间拍照,控制在0.5%左右,若荧光还是稍弱,就调大针孔,但这会失去很多细节。
4. 细节说明:
注:关于激光强度——若需要长时间拍照,做live imageing时,强度控制在0.1%以内;若短时间拍照,控制在0.5%左右,若荧光还是稍弱,就调大针孔,但这会失去很多细节。
4. 细节说明: 5. 第七组共聚焦拍图情况:红色荧光代表线粒体,绿色荧光代表微观。
5. 第七组共聚焦拍图情况:红色荧光代表线粒体,绿色荧光代表微观。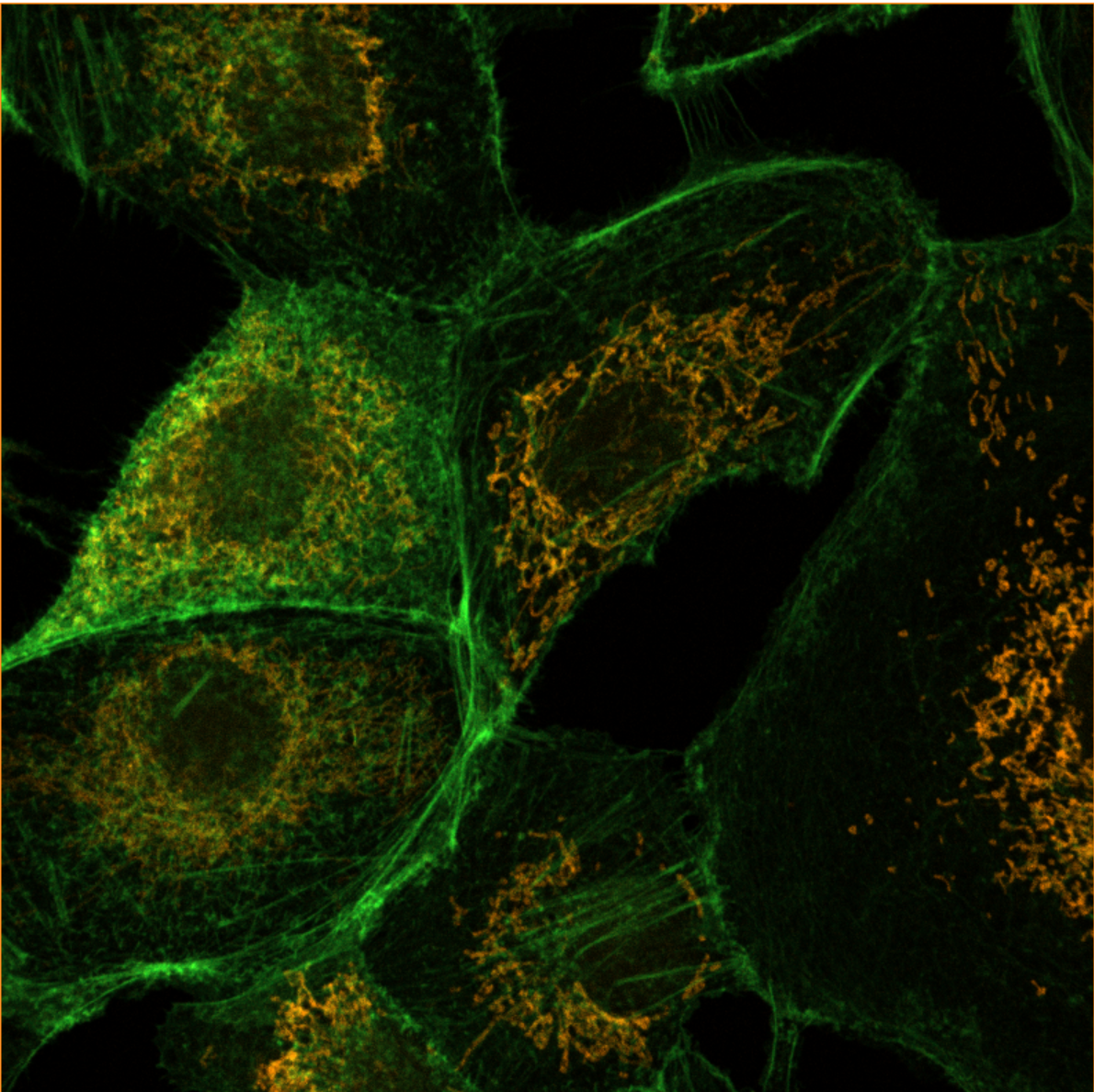
超分辨成像——SIM
- SIM的原理可直接看结构光照明超分辨显微成像技术 这一章节,其本质是在频率域上将截止频率扩增,傅里叶域上使得OTF的体积得到扩展。
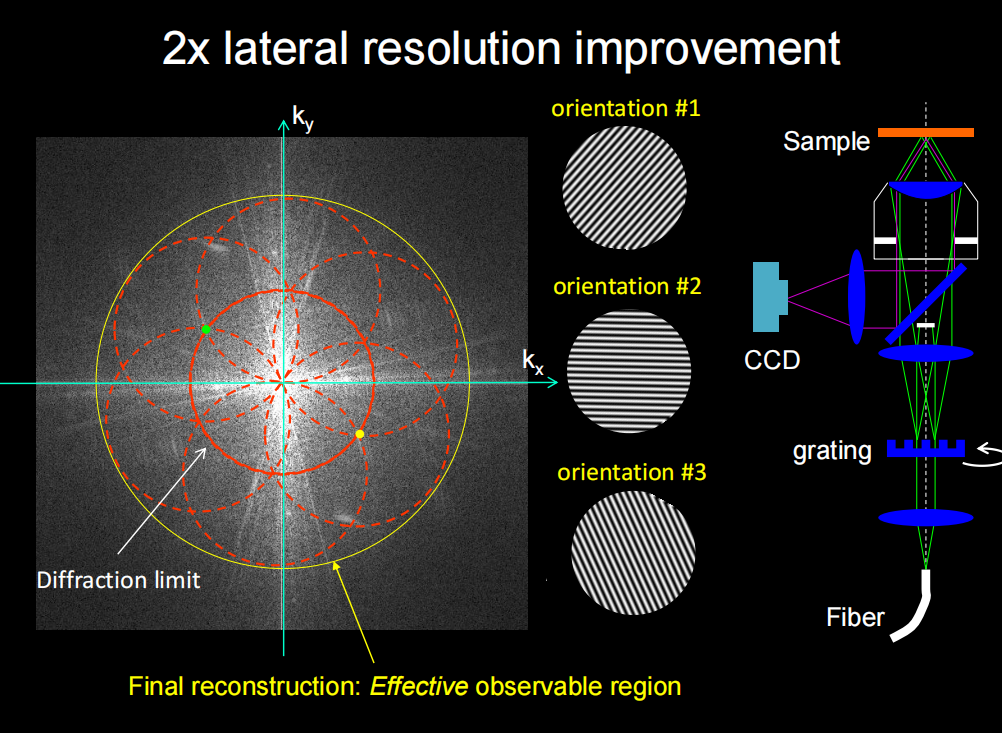
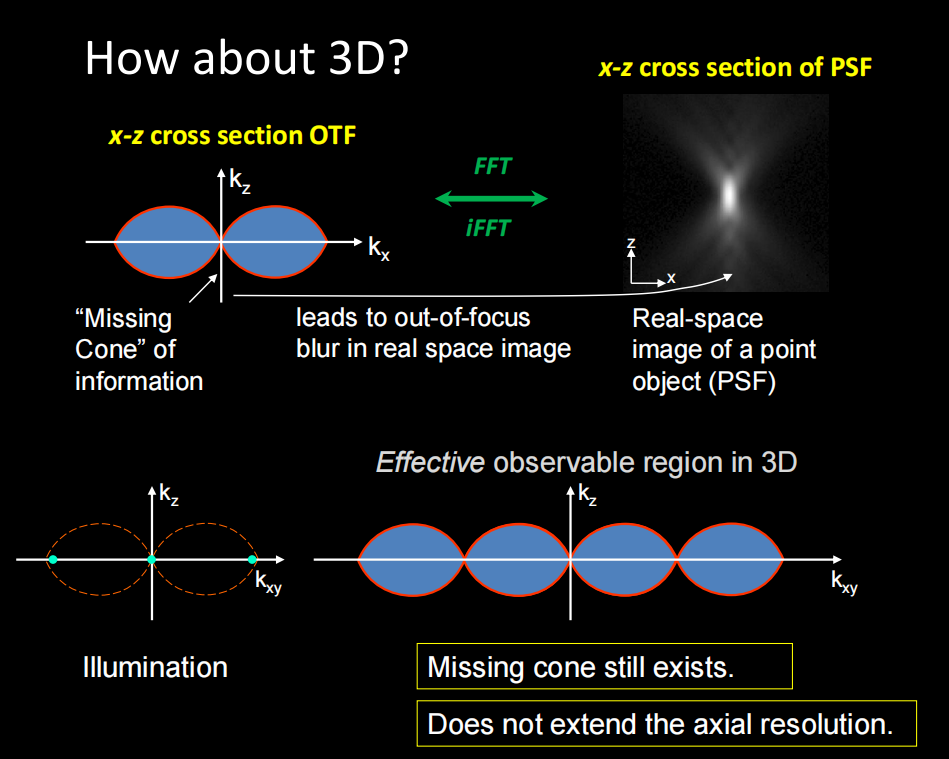
- Multi-SIM:多模态结构照明超分辨显微镜—中国科学院生物物理研究所蛋白质科学研究平台生物成像中心 (cas.cn)
 ——特色优势:该设备是生物物理所李栋老师首创的掠入射结构光照明超分辨率成像技术(GI-SIM)搭建而成,可对细胞内的生理过程进行高速、长时程、超分辨率成像,能够实现对细胞内多细胞器动态的最优化二维超分辨率成像;同时兼容了3D-SIM、TIRF-SIM等成像模式,拓展了该设备的应用范围。
——特色优势:该设备是生物物理所李栋老师首创的掠入射结构光照明超分辨率成像技术(GI-SIM)搭建而成,可对细胞内的生理过程进行高速、长时程、超分辨率成像,能够实现对细胞内多细胞器动态的最优化二维超分辨率成像;同时兼容了3D-SIM、TIRF-SIM等成像模式,拓展了该设备的应用范围。

电镜部分(电镜只能证有不能证无)
样品制备
——大致流程:取材→前固定(戊二醛)→后固定(锇酸)→脱水→浸透→包埋→切片→重金属电子染色
- 取材:组织块大小一般1.0 * 1.0 * 1.0mm(便于渗透),也允许切成2×1×1mm长形小条,用以区分组织方向,但是观察面需与长轴垂直。选择部位准确无误,无关部分必须切去。全程操作需保持在0-4℃的环境中,防止组织自溶。
- 固定(保存结构——主要是膜结构):此流程的固定方法为化学固定,还包含物理固定。——物理固定适合固定植物组织和线虫,便于立刻定格瞬时状态
- 化学固定:
- 前固定:戊二醛——戊二醛(C5H8O2)的穿透性强,能够较好的保存微细结构,长时间(一两个月左右)的戊二醛固定对于电镜组织样本影响不大。但戊二醛对组织抗原有一定影响,戊二醛还无法保存脂肪组织,并且戊二醛对细胞膜的显示显示效果不好。前固定一般采用2%-4%戊二醛固定1-2小时即可,配制后的PH溶液PH应该在7.3-7.4之间,固定前必须要预冷至4℃,戊二醛使用体积:组织块体积约40:1即可。
- 后固定:锇酸是四氧化锇,属于强氧化剂,还原后变成黑色,因此用它做后固定提高衬度(也起到了重金属染色的作用)。锇酸的渗透性较弱,每小时仅渗透0.1-0.3mm的组织,一般需要固定2小时。千万不要过久地固定,因为锇酸可以使得组织变得很硬。锇酸在受热和见光时极易分解,同时锇酸中还含有葡萄糖,该液易变质,所以需要现用现配,不可长期储备。
- 物理固定(冷冻-扫描电镜成像技术(Cryo-SEM)技术的应用 - 知乎 (zhihu.com)):目标是在低温下使液态样品中的水不结晶而呈玻璃态,这样既能将样品在液相的状态固定,又避免了水结晶引起样品结构的破坏。最后亦需要脱水(梯度升温脱水,时间较为缓慢,可长达月)。相较于化学固定,冷冻固定的优势在于其最真实、无染色、组织的形变小,但其衬度要低很多。
- 化学固定:
- 脱水:用无水乙醇和丙酮进行梯度脱水。

- 浸透:脱水后,利用环氧树脂进行梯度填充*。
- 包埋:包埋时使用配套的特定模具,利用树脂填充包埋(尽量吧样品放在包埋快靠前的位置,避免切片时耗时过长,但也需要留一定的修片距离),后置入60℃烤箱中,烤24-36小时即可。
- 切片:电镜组织切片要求为超薄切片,一般为70nm左右。可以预先削出0.5-2μm的厚切片(修快的过程);切片后超薄切片用配套的3mm直径铜网承载,而不是用载玻片承载的,这以便接受电子束的轰击。
- 重金属染色:

TEM——透射电子显微镜
- 大致构造与原理:电子显微镜与光学显微镜的成像原理基本一样,所不同的是前者用电子束作光源,用电磁场作透镜。电子显微镜的放大倍数最高可达近百万倍、由照明系统、成像系统、真空系统、记录系统、电源系统5部分构成,如果细分的话:主体部分是电子透镜和显像记录系统,由置于真空中的电子枪、聚光镜、物样室、 物镜、衍射镜、中间镜、 投影镜、荧光屏和照相机。TEM经加速和聚集的电子束投射到非常薄的样品上,电子与样品中的原子碰撞而改变方向,从而产生立体角散射。散射角的大小与样品的密度、厚度相关,因此可以形成明暗不同的影像,影像将在放大、聚焦后在成像器件(如荧光屏、胶片、以及感光耦合组件)上显示出来。

- 物镜聚焦:主要特点是通过调节物镜电流改变焦距

- 拍摄过程中所遇到的主要问题——像散
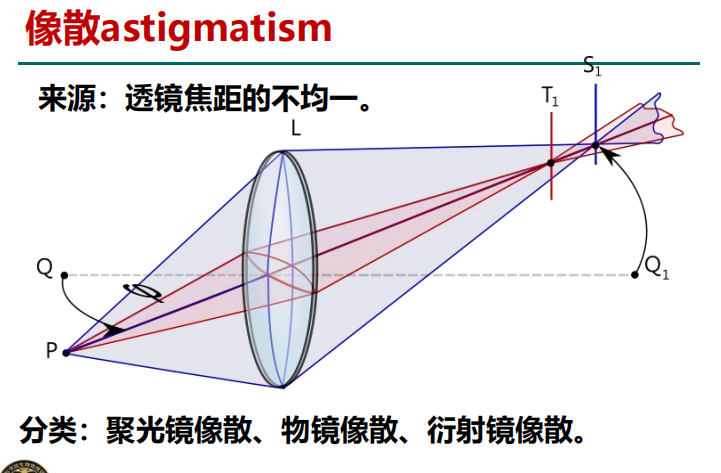 注:其他可能出现的问题包括球差(物镜是非理想透镜)、色差(光源的色散)、慧差(入射光与光轴有一夹角)。
注:其他可能出现的问题包括球差(物镜是非理想透镜)、色差(光源的色散)、慧差(入射光与光轴有一夹角)。
SEM——扫描电子显微镜
- 大致构造和原理:不同于透射显微镜,扫描电子显微镜是利用反射或撞击扫描样品近表面区域的电子来产生图像。
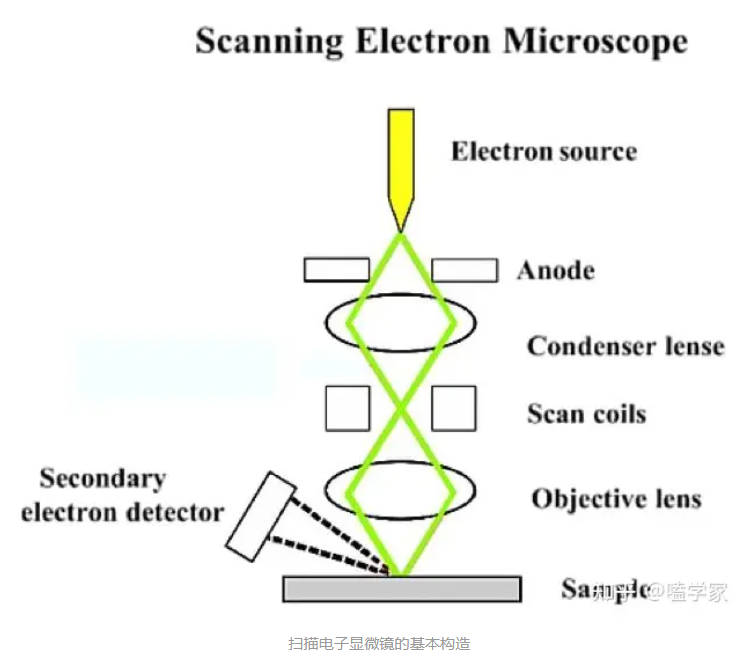
- 扫描电子显微镜的改进:
- SEM+离子束:可以对样品进行加工,如减薄(起到了修片的作用)或者沉积离子。
- SEM+光镜:荧光显微镜和电子显微镜的结合助于重要结构的共定位,荧光可在电子显微镜的基础上进一步提高衬度(除了荧光外,提高衬度的方法还有免疫染色如胶体金染色等方法)