名词解释:
-
TCB-1-1 前言 1. Cytology(细胞学):指对细胞形态(特别是染色体形态)的观察,细胞学发展成细胞生物学,细胞生物学又从显微水平、超微水平和分子水平等不同层次研究细胞结构、功能及生活史。
- 四大基础学科:细胞生物学、分子生物学、神经生物学和生态学
- 组学(Omics):是一些种类个体的系统集合,如基因组学(Genomics),这门学科就是研究基因以及这些基因间的关系(研究基因组和如何利用基因的学问);蛋白组学(Proteomics),研究蛋白质的鉴定、翻译后修饰、蛋白质的功能确定等;转录组学(Transcriptomics),研究细胞在某一功能状态下所含mRNA的类型与拷贝数,如单细胞转录组;代谢组学(metabolomics),对生物体内所有代谢物进行定量分析,寻找代谢物和生理病理变化的相对关系。
-
TCB-1-2 细胞生物学与培养细胞生物学
- 细胞(Cell):是所有生物体【不包括病毒、类病毒、朊粒等之外】形态结构与功能活动的基本单位,具有完整生命力的生物的最小单位。
- 细胞生物学(Cell Biology):研究细胞基本生命活动规律的科学,在不同层次(显微、亚显微与分子水平)上,以研究细胞结构和功能,细胞增殖、分化、衰老与凋亡、细胞信号传递,真核细胞基因表达与调控、细胞起源与进化等内容。
- 培养细胞学(Cultural Cytology):应用细胞培养技术研究离体细胞的生命现象和规律,比较体内外细胞的特点与差异,通过模拟生理条件的革新,减少体内外细胞的特征差异,从细胞和分子水平上揭示生物体生老病死的机制(这也是细胞培养的目的与意义)。
-
TCB-1-3 细胞与细胞培养
- 体外培养(in vitro):在体外或试管内进行培养。
- 组织培养(tissue culture):维持组织在体外的生长,也泛指体外培养。
- 器官培养(organ culture):维持器官、器官的部分或器官的原基在体外生存或生长的方法。
- 细胞培养(cell culture):细胞在体外条件下生长称为细胞培养,细胞不再形成组织。本意是从活体内取出组织或细胞,通过模拟体内生理环境,建立无菌、适温和一定的营养条件,使细胞生长的方法。
- 细胞融合(cell fusion):在体外培养的条件下,经过化学融合剂(如聚乙二醇PEG)、病毒(仙台病毒)或物理方法(电脉冲)等诱发,使不同体细胞融合产生杂交细胞(hybrid)。
 注:(1)融合过程:细胞凝集—膜粘连—融合形成多核细胞—多核细胞又进行核的融合形成单核的杂种细胞。(2)自发融合(受精+质配)
注:(1)融合过程:细胞凝集—膜粘连—融合形成多核细胞—多核细胞又进行核的融合形成单核的杂种细胞。(2)自发融合(受精+质配)
- 细胞杂交(cell hybridization):2个和多个不同细胞的融合,导致一个多核细胞的形成。
- 细胞系(cell line):原代培养物经首次传代成功后所繁殖的细胞群体,也指长期连续传代的培养细胞。由原细胞系分离出具有与原细胞系不同性状的细胞系称为亚系。
- 细胞株(cell strain):通过选择法或克隆形成法从原代培养物或细胞系中获得的特殊性质或标记物,并能保持这些特性的培养物为细胞株。由原细胞株分离出具有与原株性状不同的细胞株成为亚株。
- 细胞周期(cell cycle):是指细胞从前一次分裂结束开始至本次分裂结束所经历的时相过程,细胞生长的过程由分裂期(M期)和分裂间期组成。分裂间期由DNA合成期(S期)、DNA合成前期(G1期)、DNA合成后期(G2期)组成。G2期又称分裂前期,为间期向M期转变作准备,故细胞周期由G1、S、G2和M四个连续的时期构成。
- 休止(quiescent):静止,为细胞处于不分裂的状态,常处于G1期或G0期。
- 细胞一代时间(cell generation time):单个细胞两次连续分裂的时间间隔。
- 代或世代(generatioin):从细胞接种到下一次传代再培养的时间的一段时间叫一代。培养一代,作为单个细胞可倍增3-6次,作为群体细胞要经历游离期、对数期与停止期三个阶段。
- 群体倍增时间(population doubling time):在对数生长期进行计算的细胞增加一倍所需的时间,如细胞数从1x10^6增加到2x10^6个所需的时间。
- 原代培养(primary culture):从体内取出组织或细胞的第一次培养(模拟体内的生理环境,在无菌、适温和丰富的营养条件下,使离体细胞或组织生存、生长并维持结构和功能的一项技术)。首次成功传代培养之前的培养称为原代培养。
- 传代(passaging cells):无论是否稀释,将细胞从一个培养皿中转移到另一个培养皿中即称为传代或传代培养。
- 单层培养(monolayer culture):培养细胞在底物上平铺长成单层细胞
- 贴壁依赖性(anchorage-dependent):细胞需贴附于底物或支持物上才能生长的性质为贴壁依赖性。贴附于物体表面(不受化学作用)而繁衍出来形成单层的细胞称贴壁依赖性细胞。
- 汇合(confluence):在器皿中的细胞相互连接,彼此汇合形成单层。
- 接触抑制(contact inhibition):贴壁生长的体外细胞一旦汇合、相互接触后便停止了分裂增殖,不再进入S期,也不会出现交叉重叠生长。
- 悬浮培养(suspension culture):细胞或细胞聚集体悬浮于培养液中增殖,这些细胞具有不依赖于贴附底物或支持物生长的性质,如淋巴细胞、血液肿瘤细胞等均悬浮培养,无贴壁性。
- 密度抑制(density inhibition):悬浮培养细胞的数量达到一定密度后引起抑制增殖的现象。
- 群体密度(population density):培养器皿内每单位面积或体积内的细胞数,多用细胞数/平方厘米表示
- 饱和密度(saturation density):在特殊培养条件下,每平方厘米(单细胞培养)或每毫升细胞悬液中可达到的最大细胞数。当细胞数达到饱和密度后,细胞群体停止繁殖。
- 克隆(clone):单个细胞通过有丝分裂形成的细胞群体,它们遗传特性相同,使培养物的遗传可变性减少。
- 接种率(plating efficiency):细胞接种到培养皿内所形成集落(colony)的百分率。接种率与接种细胞的数量、接种瓶的种类及环境条件(培养液、温度等)相关。
- 接种存活率(seeding efficiency):接种一定量细胞后,经一定时间培养,能依附于底物存活的细胞百分数,又称贴壁率。
- 克隆形成率(cloning efficiency):向底物接种单个细胞悬液,获得均一的细胞集落的百分率,而且能肯定每个集落的后裔细胞均起源于一个共同的祖细胞。
- 二倍体细胞系或株(diploid cell line or strain):具有两套染色单体数目,即具有二倍体核型的细胞系或株。大多数二倍体细胞为有限细胞系。
- 有限细胞系(finite cell line or strain):细胞系或株形成后仅能维持有限传代数,如一般二倍体细胞系仅能传50代左右,最后衰老死亡。
- 连续或无限细胞系或株(continuous or infinite cell line or strain):具有无限繁殖能力,即获得了不死性,能反复进行传代的细胞系或株。
- 核型(karyotype):一个细胞全部染色体的组成和特征。
- 干细胞(stem cell):来源于胚胎、胎儿或成体中未分化的具有继续分化潜能的细胞。胚胎干细胞(embryonic stem cell)是指来自于胚胎期桑葚胚的卵裂球或胚泡的内细胞团(ICM),具有自我更新和多能性;胚胎生殖干细胞与胚胎干细胞来源于不同组织,但二者具备相似的发育和分化潜能和特征。
- 细胞凋亡(apoptosis):由体内外因素触发细胞内死亡程序开启而导致细胞自杀过程,故也称为程序性细胞死亡(programmed cell death)。细胞凋亡被看作细胞生理性、主动性的死亡过程,受某些基因的调控(p53、c-myc等),其特征为细胞皱缩、染色质聚集、周边化及形成凋亡小体。
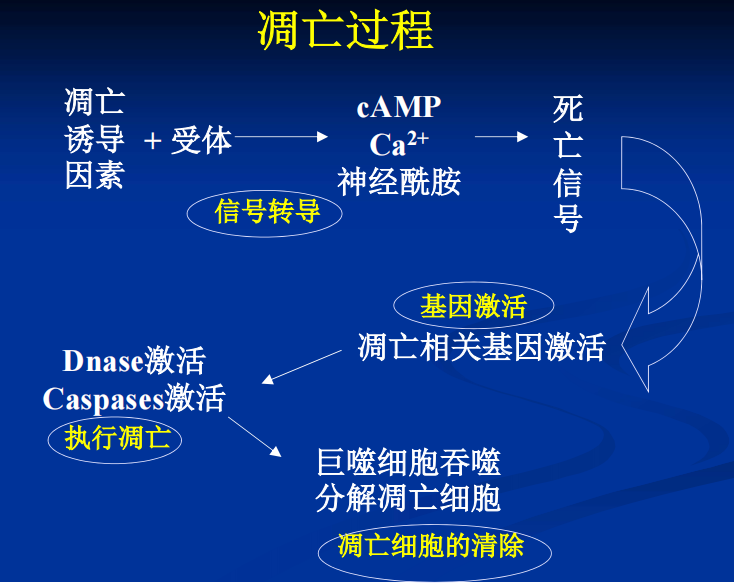
- 转染(transfection):用生物学或物理、化学的方法将某细胞的某个基因转移到细胞核内的一种手段。常用阳离子脂转染试剂(磷酸钙共沉淀、电穿孔、DEAE、机械法),该试剂能包裹DNA形成脂质体-DNA复合物,再通过融合,可使DNA转染人培养细胞中。

- 体外转化(in vitro transformation):细胞在体外培养过程中发生了与原代细胞性状不同的转化,可遗传变异(DNA或基因突变),但不具有致瘤性。——受物理因素(射线)、化学因素(MNNG)、病毒(EBV、SV40)。无任何诱变产生的转化是自发转化。
- 自发转化(Spontaneous transformation):在未施加任何诱变因素处理的情况下,细胞自发出现的转化(原因不明)。特点是细胞失去接触抑制,生长速度变快,形成转化灶。
- 人工诱发体外转化(Artificial-introduction):可用于研究癌变原理,通过体外细胞培养,并用人工方法诱发转化,构建体外癌变模型。
- 体外恶性转化(in vitro malignant transformation):细胞在体外培养过程中获得了致瘤性转化,当把这种转化细胞接种于适当的动物后可产生肿瘤。
-
lecture-2 细胞分析技术
- 细胞凋亡——细胞程序性死亡(programmed cell death,PCD),细胞增殖与其共同维持生理稳态,主要的两条通路是膜受体通路和线粒体通路。
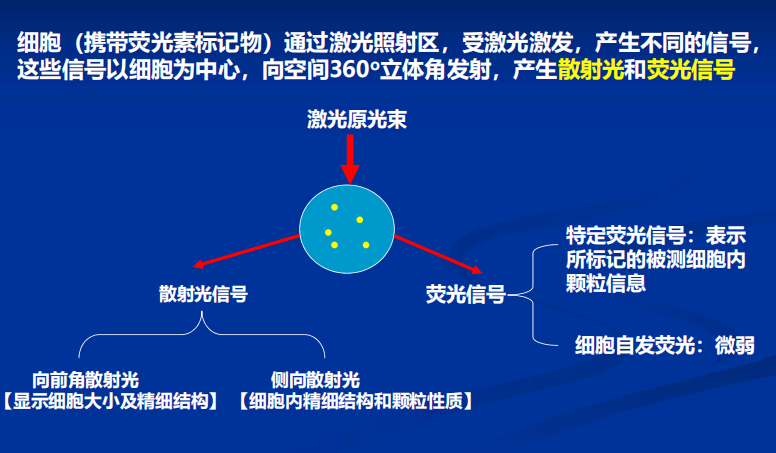
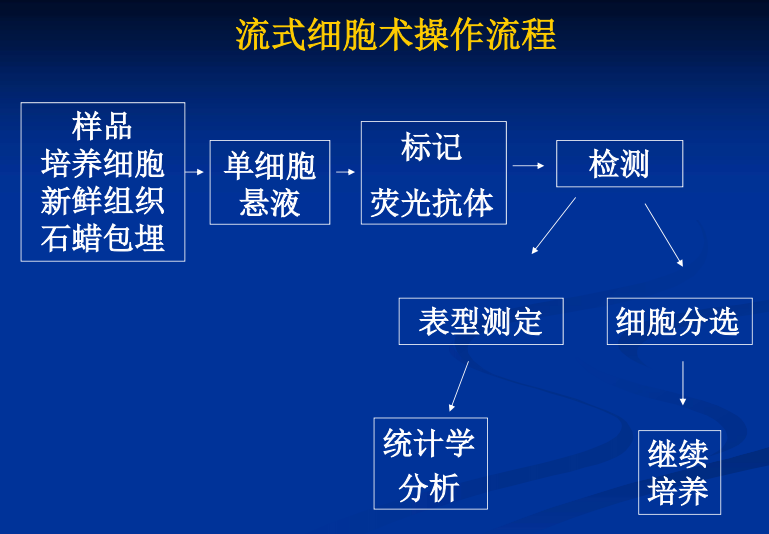
- 流式细胞术(Flow Cytometry):利用流式细胞仪对处在快速、直线、流动状态中的单细胞或生物颗粒进行多参数(FSC:细胞大小;SSC:反应细胞内颗粒性与细胞精细结构)、快速定量分析,同时对特定群体加以分选的现代细胞分析技术。【组成:流动室和液流系统;激光源和光学系统;光电管和检测系统;计算机和分析系统】



-
lecture-3 显微技术
- 相差显微镜(Phase Contrast MIcroscope):相差显微镜能够改变直射光或衍射光的相位,并且利用光的衍射和干涉现象,把相差变(即光程差)成振幅差(明暗差,提高结构的对比度),同时它还吸收部分直射光线,以增大其明暗的反差。因此可用以观察活细胞或未染色标本。

- 暗视野显微镜(Dark Field Microscope):使用中央遮光板或暗视野聚光器,把光源的中央光束阻挡,只能看物体的运动,细微结构难以辨别。

- 偏光显微镜(Polarizing Microscope):配有尼克尔棱镜,能将普通光变成偏振光。用于检测具有双折射性的物质,如纤维丝、纺锤体、胶原、染色体等。
- 荧光显微镜(Fluorescence Microscope)+[共聚焦#^f808ae|激光共聚焦扫描显微镜]
- [电子显微成像技术——透射电镜#^8b1893|电子显微镜]:电子束透过样品经过聚焦与放大后所产生的物像, 投射到荧光屏上或照相底片上进行观察。电子束的波长短,并且波长与加速电压(通常50~120 KV)的平方根成反比。电子束投射到质量大的结构时,电子被散射的多,因此投射到荧光屏上的电子少而呈暗像,电子照片上则呈黑色。称电子密度高(electron dense)。反之,则称为电子密度低(electron lucent),通过负染技术,即通过重金属盐在样品四周堆积加强样品外周的电子密度,可衬托样品的形态和大小(凹陷处有染料堆积,凸出地方无)
- [扫描电镜基本原理及应用#^a75f65|扫描电子显微镜]:是用一束极细的电子束扫描样品,在样品表面激发出次级电子,次级电子的多少与样品表面结构有关,次级电子由探测器收集,信号经放大用来调制荧光屏上电子束的强度,显示出与电子束同步的扫描图像。为了使标本表面发射出次级电子,标本在固定、脱水后,要喷涂上一层重金属膜,重金属在电子束的轰击下发出次级电子信号。
- 相差显微镜(Phase Contrast MIcroscope):相差显微镜能够改变直射光或衍射光的相位,并且利用光的衍射和干涉现象,把相差变(即光程差)成振幅差(明暗差,提高结构的对比度),同时它还吸收部分直射光线,以增大其明暗的反差。因此可用以观察活细胞或未染色标本。
-
lecture-4 亚细胞结构的分离
- 差速离心(Differential centrifugation):逐渐加大离心力的顺序离心的过程将根据细胞成分的大小和密度来实现分离。

- 密度梯度离心:用介质(蔗糖)在离心管内形成一连续或不连续的密度梯度,将细胞混悬液或匀浆置于介质的顶部,通过离心力场的作用使细胞分层、分离。

- 差速离心(Differential centrifugation):逐渐加大离心力的顺序离心的过程将根据细胞成分的大小和密度来实现分离。
-
TCB-3-1 显微技术
- 微分干涉显微镜(DIC):优点是能显示结构的三维立体投影影像。与相差显微镜相比,其标本可略厚一点,折射率差别更大,故影像的立体感更强。
- 倒置显微镜(Inverse Microscope):物镜和照明系统颠倒,物镜在载物台之下。
- 冰冻蚀刻(freeze-etching):

- 电子探针X射线显微技术(Electron Probe X-ray Microanalyser):在真空中用聚焦很细的电子束照射待测样品,用X线波谱或能谱分析法测量所产生特征X线的波长或能量及其强度,从而对该微小区域所含元素进行定性和定量分析。
- 扫描探针显微镜(Scanning Probe Microscope, SPM,具备很高的空间分辨率,横向达0.1nm,纵向优于0.01nm):能直接观察到物质表面的原子结构;而且还能对原子和分子进行操纵,从而将人类的主观意愿施加于自然。(材料科学、DNA双螺旋结构)

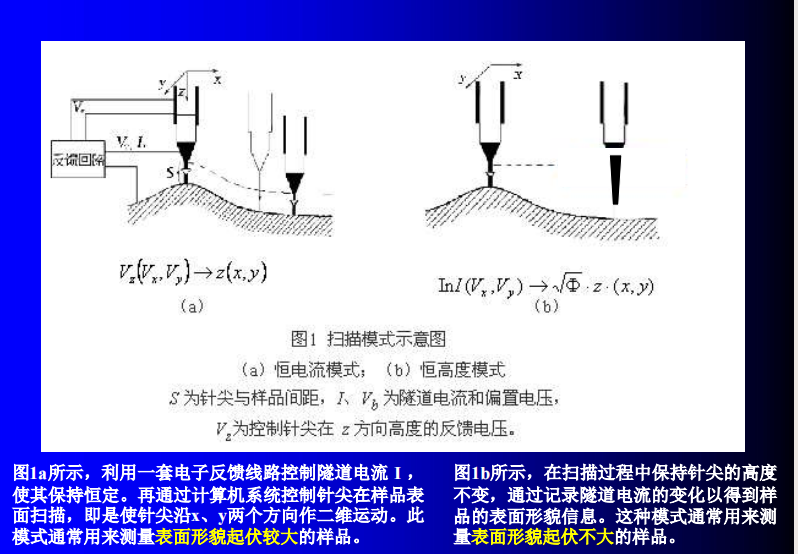
- [细胞成像技术综述——Ch1#^775f1c|原子力显微镜]
- 显微分光光度术(Microspectrophotometry):细胞内某种物质的含量不同,其染色反应的深浅不一,对一定波长的光吸收也不同,可通过测定其光密度值(OD值)进定量分析比较,从而对组织和细胞内化学成分进行定位、定性和定量分析。——测量DNA含量变化、细胞形态学变化、吸收光谱测定等。
- 显微荧光光度术(Microfluorometry):利用显微分光光度计(microspectro-photometer)对组织和细胞内原有能发荧光的物质、或对细胞内化学成分用不同的荧光探剂标记后,进行定位、定性和定量分析的技术。
- 显微操作技术(Micromanipulation Technique):
 人工生殖技术(ART):人工授精、试管婴儿;辅助孵化(assisted hatching):透明带上制造缺口,增加着床可能性。
人工生殖技术(ART):人工授精、试管婴儿;辅助孵化(assisted hatching):透明带上制造缺口,增加着床可能性。
-
TCB-3-2 激光扫描共聚焦显微镜及技术(LCSM)
- Confocal(LCSM):功能是采集图像【二维三维成像、透射光+反射光】、荧光信号定性和定位、定量测定荧光强度【动态监测活细胞动态荧光信号】
- 自发荧光(Autofluorescence):自发荧光是指组织细胞不经任何荧光染色,便能够在短波长光的激发下发射出的荧光。如绿色荧光蛋白(GFP)。在荧光测定中,自发荧光会干扰测定。
- 诱发荧光(Induced fluorescence):生物胺类物质(如儿茶酚胺)能与某些醛类物质在一定条件下缩合而发射强荧光,称之为诱发荧光。该法敏感度高而且特异,能显示含量低至5×10^-16 g的去甲肾上腺素。
- 酶致荧光(Enzymatically produced fluorescence):某些酶的反应产物能够发射荧光,例如在脱氢酶反应中辅酶I变为还原型辅酶后,能发射红荧光。细胞内酯酶可以将不发荧光的二醋酸荧光素(FDA)转化成发荧光的荧光素,根据产物荧光可以推导酶和酶促反应强度。
- 荧光共振能量转移(FRET)
- 荧光原位杂交(FISH):用标记有荧光素的DNA或RNA为探针,在原位检测组织细胞内特定DNA或RNA片段,特定条件下与细胞内的DNA或RNA形成稳定的杂交体(DNA-DNA、DNA-RNA、RNA-RNA)。——应用于染色体数目和结构异常,基因缺失、断裂、融合检测,尤其是在检测细胞内DNA或RNA的某种特定序列的存在与否最为成功。
-
TCB-4-1 细胞培养技术
- 干细胞(Stem cell):细胞在分化过程中往往由于高度分化而完全失去了再分裂的能力,最终衰老死亡。机体在发展适应过程中为了弥补这一不足,保留了一部分未分化的原始细胞,称之为干细胞。一旦需要,这些干细胞可按照发育途径通过分裂而产生分化细胞。——可用于药物筛选、发育生物学、细胞治疗的研究
- 全能型:巨有形成完整个体的分化潜能,如胚胎干细胞(核型二倍体、发育多潜能性、无限增殖、具有培养细胞的特征)
- 专门型:只能向一种类型或密切相关的两种类型的细胞分化,如造血干细胞。
- 干细胞(Stem cell):细胞在分化过程中往往由于高度分化而完全失去了再分裂的能力,最终衰老死亡。机体在发展适应过程中为了弥补这一不足,保留了一部分未分化的原始细胞,称之为干细胞。一旦需要,这些干细胞可按照发育途径通过分裂而产生分化细胞。——可用于药物筛选、发育生物学、细胞治疗的研究
-
超分辨荧光显微镜应用研究细胞生物学
- 激光扫描共聚焦显微镜:优势——激发光能量和收集的探测光能量集中在成像面附近,这减少了离焦的背景
- 双光子显微镜:两个光子激发一个荧光信号光子,这提高了激发光的阈值,有利于减少衍射产生的干扰
- STED(受激发射损耗技术):采用两束激光同时照射样品,其中一束激光用来激发荧光分子,使物镜焦点艾里斑范围内的荧光分子处于激发态;同时,用另外一束中心光强为零的环形损耗激光与之叠加,使物镜焦点艾里斑边沿区域处于激发态的荧光分子通过受激辐射损耗过程返回基态而不自发辐射荧光,因此只有中心区域的荧光分子可自发辐射荧光,从而获得超衍射极限的荧光发光点。
- SIM(结构光照明技术):利用带有精细条纹图案的照明光照射到样品上生成莫尔条纹,使得样品中原本超越物镜分辨能力的精细结构部分对应的高频信息移动到低频区域从而被探测到(两个高频信号重叠,形成低频率莫尔条纹)。照明过程中需要改变结构照明方向和相位得到一系列含有莫尔条纹的荧光图像,然后对图像进行处理,还原出复杂结构的高分辨率图像。SIM最多只能将分辨率提升一倍,100 nm左右。
- 单分子显微技术(PALM、STORM):通过重复扫描目标样本,并在每次拍摄时只让少量、离散的分子发光,再通过高斯拟合,定位单个荧光分子(点扩散函数)的中心位置,以实现高精度的空间定位,最后将系列图片叠加合成一幅超分辨图像。最后把所得图像重迭在一起,得到突破“衍射极限”的高分辨率显微影像。
- STORM(随机光学重建):基本原理与PALM类似,不同的是STORM使用合成的光转换荧光染料,而不是光激活荧光蛋白与目标分子结合。
 注:3D-STORM——随焦点变化取得的信号,满足椭圆形的高斯分布
注:3D-STORM——随焦点变化取得的信号,满足椭圆形的高斯分布 - PALM:通过“开关”与目标分子结合的光激活荧光蛋白,对其进行分批定位,确定中心光斑的位置。
- STORM(随机光学重建):基本原理与PALM类似,不同的是STORM使用合成的光转换荧光染料,而不是光激活荧光蛋白与目标分子结合。
-
TCB-5-1 培养细胞分析技术 1. 单克隆抗体:将小鼠产生抗体的脾细胞和小鼠的骨髓瘤细胞融合在一起产生杂交细胞,这种细胞既获得了亲代脾细胞分泌特异性抗体的特性又有骨髓瘤细胞体外培养的特性。 2. 细胞同步化(cell synchronization):使细胞群中的绝大部分细胞“集聚”在细胞周期中的同一时间,并使之同步进入细胞周期的方法。这利于深入了解细胞周期各个不同阶段细胞的结构核功能。
-
TCB-6-3 免疫荧光显微术
- 免疫荧光(immunofluorescence):利用抗体和生物分子(抗原)的特异性结合,通过荧光结合合抗体对抗原的特异性标记显现图像,从而对标本中的抗原进行定性、定量和定位。
- 光谱辨别(spectrum discrimination):将自身荧光的影响减至最低。光谱辨别包括选择适当的探针和滤光器以使探针的荧光信号相对于自身荧光之比达到最大。
- 免疫酶标记技术(Immunoenzymatic Technique):用酶标记抗体或酶标记抗抗体进行抗原-抗体反应。酶和底物反应后可产生有色沉淀物,借助一般光学显微镜或电子显微镜进行定位、定性研究,也可应用光电比色计或酶标仪进行定量测定。
-
真核细胞转染技术
- 转染(Transfection)和感染(Infection):细胞转染技术是指将外源分子如DNA、RNA等导入真核细胞的技术。转染是通过病毒不依赖的方式将核酸导入细胞中,而感染是借助病毒将核酸导入细胞中。——目的是研究基因和蛋白质功能(蛋白的亚细胞定位)、基因表达调控、信号转导、突变分析(Knockin Knockout)、基因治疗。
- 质粒(plasmid):是细菌、酵母菌等生物中染色体(或拟核)以外的DNA分子,具有自主复制能力的闭合环状双链DNA分子,能表达所携带的遗传信息。质粒不是细菌生长繁殖所必需的物质。例如哺乳动物细胞表达载体——

- 报告基因(reporter gene):编码可被检测的蛋白质的基因,其编码序列和目的基因融合形成嵌合基因,利用其表达产物来检测目的基因表达。【序列已知、表达产物在受体细胞中不存在、表达产物可定量】——荧光蛋白报告系统、半乳糖苷酶报告系统、荧光素酶报告系统
-
RNA干扰技术
- RNAi:利用双链小RNA高效、特异性地降解细胞内同源RNA从而阻断基因表达,使细胞出现靶基因表达敲低的表型。
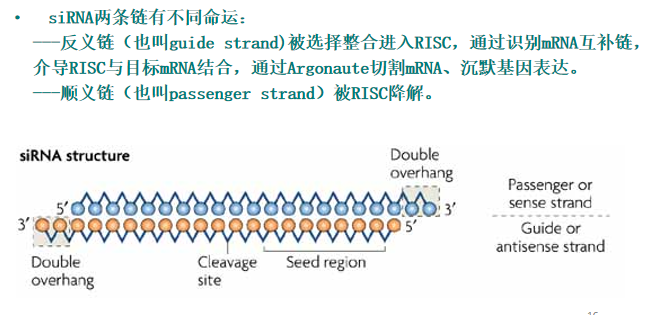

- RICS(RNA-induced silencing complex):具有核酸内切、外切和解旋酶活性。【2】
- Dicer:以一种ATP依赖的方式逐步切割由各种方式引入的dsRNAs,将RNA降解为18-25bp的siRNA。【1】
- Argonaute蛋白(Ago):RNAi机制正是由Ago蛋白的RNA切割酶活性主导,其导致mRNA降解或者翻译抑制
- Rdrp(RNA-dependent RNA polymerases):是RNAi的调节因子,以靶mRNA作为模板,以导入的dsRNA(或siRNA)作为引物合成 RNA,催化细胞内新siRNA合成,使RNAi可以在生物体内传递。
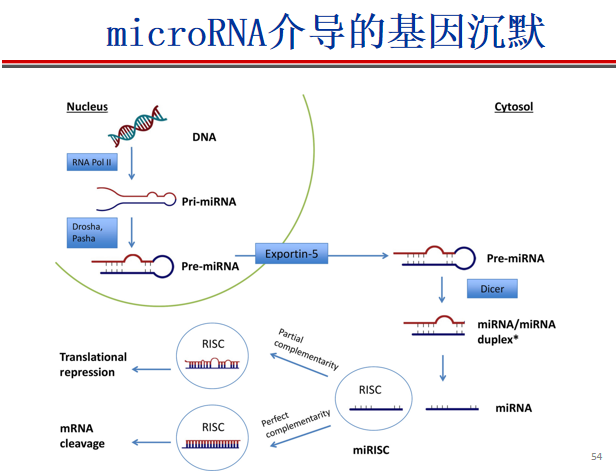
- MicroRNA:前体具有类似发夹性的茎环结构,miRNA产生于该茎环结构的双链区(通过Dicer),其作用特点与siRNA基本相同。
- CLIP-Seq:基于RNA分子与RNA结合蛋白在紫外照射下发生耦联,以RNA结合蛋白的特异性抗体将RNA-蛋白质复合体沉淀之后,回收其中的RNA片段,经添加接头、RT-PCR等步骤,对这些分子进行高通量测序,再经生物信息学的分析、挖掘其特定规律,从而深入揭示RNA结合蛋白与RNA分子的调控作用。
- RNAi:利用双链小RNA高效、特异性地降解细胞内同源RNA从而阻断基因表达,使细胞出现靶基因表达敲低的表型。
-
基因编辑 基因编辑技术:又称基因组定点修饰技术,通过在基因组中进行靶向特异性突变,从而实现永久性或条件性(conditional, 组织或时空)特异性的基因敲除、敲入和纠正。
-
细胞高内涵技术及应用:
- 细胞高内涵分析技术(High Content Analysis/Screening, HCS):保持细胞结构和/或功能完整性的前提下,高内涵细胞学分析筛选系统可以对细胞进行快速、实时、多通道、多靶点的荧光扫描检测。由CCD成像捕获高质量图像信息后,再应用强大的软件分析系统对图像进行多指标分析,可以在单个细胞/亚细胞/蛋白水平上,同时获取样品生物学效应变化的多个指标及其多元化、功能性的海量数据。最终在分析样品的多维生物效应信息的基础上,可以获取药物/siRNA或各类刺激对细胞生物效应的综合评价。高内涵技术实现了高速高分辨显微成像,将以前耗时费力的工作短时间完成,综合海量信息快速做出决策。


- 细胞高内涵分析技术(High Content Analysis/Screening, HCS):保持细胞结构和/或功能完整性的前提下,高内涵细胞学分析筛选系统可以对细胞进行快速、实时、多通道、多靶点的荧光扫描检测。由CCD成像捕获高质量图像信息后,再应用强大的软件分析系统对图像进行多指标分析,可以在单个细胞/亚细胞/蛋白水平上,同时获取样品生物学效应变化的多个指标及其多元化、功能性的海量数据。最终在分析样品的多维生物效应信息的基础上,可以获取药物/siRNA或各类刺激对细胞生物效应的综合评价。高内涵技术实现了高速高分辨显微成像,将以前耗时费力的工作短时间完成,综合海量信息快速做出决策。
简答题
-
为什么说细胞是一切生命活动的基本结构和功能单位?

-
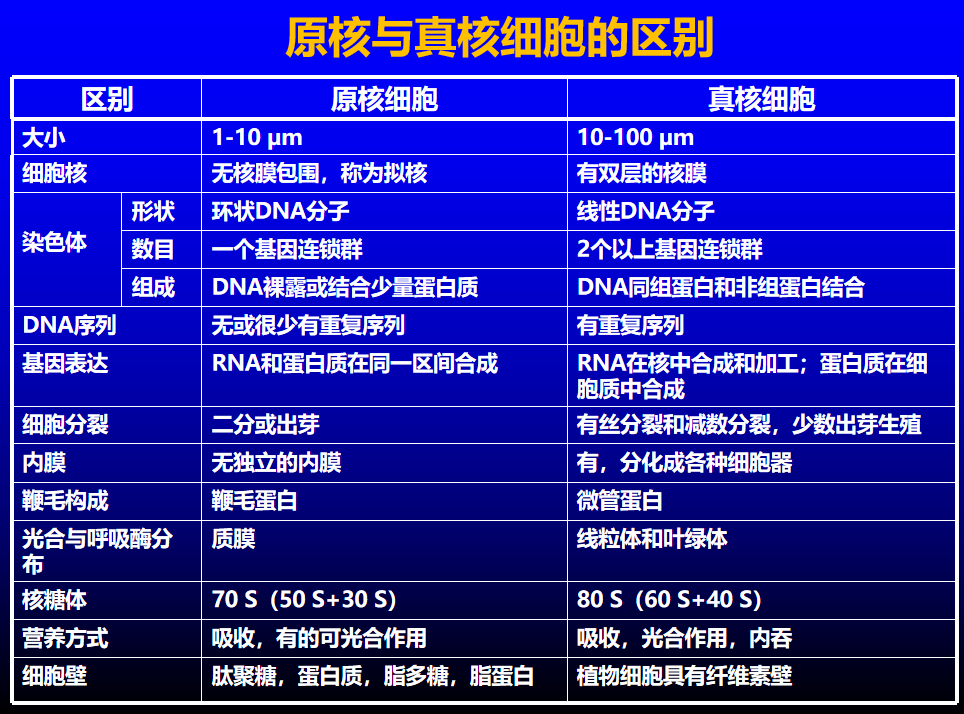
比较一下真核细胞核原核细胞的差异:
-
如何鉴定细胞的自发转化?

-
当细胞出现了自发转化时,如何处理?:利用细胞刮去除转化灶,后传代并冻存正常细胞;倘若细胞有冻存样,重新复苏新的细胞进行传代。
-
如何检测细胞的侵袭和迁移能力?——Transwell实验是检测细胞迁移能力和侵袭能力常用的实验手段,此外亦可研究细胞间关键物质的转运能力,如外泌体。
-
3D细胞培养相比2D细胞培养的优势是?——模拟体内的生理环境,让细胞在生理行为上与机体实际的生理环境更接近。
-
细胞凋亡有哪些检测方法(细胞凋亡的形态特征)?
- 形态学检测:通过光学显微镜或电镜观察——凋亡细胞变形且体积小,早期核浓缩,晚期核碎裂,细胞质浓缩,膜完整但出现发泡现象,凋亡晚期可见凋亡小体;还可通过核型来评判细胞凋亡进展情况,如DAPI(荧光显微镜)。
- 细胞内氧化还原状态改变的检测:细胞内GSH的排除非常活跃时,细胞液就由还原环境转为氧化环境,这可能导致了凋亡早期细胞线粒体膜电位的降低,从而使细胞色素C(三羧酸循环中的重要组分)从线粒体内转移到细胞液中,启动凋亡效应器caspase的级联反应。——通过MCB荧光染料体外检测凋亡细胞细胞质中GSH的减少,从而检测凋亡早期细胞内氧化还原状态的变化。
- 磷脂酰丝氨酸(PS)外翻分析:在凋亡早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。——以荧光素标记的Annexin-V(可与PS特异性结合)作为荧光探针,利用流式细胞仪、荧光显微镜以及共聚焦激光扫描显微镜检测细胞凋亡的发生。
- 线粒体膜势能(DYmt)的检测:凋亡时,线粒体跨膜电位DYmt的下降。利用JC-1可检测模式能的变化,正常情况下,JC-1进入线粒体形成多聚体,发红色荧光,凋亡状态下,JC-1在细胞质内,单体发绿色荧光。——利用流式细胞仪进行凋亡细胞和正常细胞的分选。
- 细胞色素C的定位检测:细胞色素C氧化酶亚单位IV(COX4)在凋亡发生时保留在线粒体内。
- DNA片段化:跑胶(琼脂糖凝胶电泳中可呈特征的阶梯状条带—DNA ladder,是判断细胞凋亡的客观指标之一) or TUNEL标记法——断裂部位发生在染色质核小体的连接部,此处易受内源性核酸内切酶的攻击而断裂

- Caspase介导凋亡检测:当细胞发生凋亡时caspase可以被蛋白酶裂解,大亚基和小亚基形成活化的caspase。一些caspase活化后可以次序激活其他caspase形成caspase(3、8、9)级联反应,促发细胞凋亡。
-
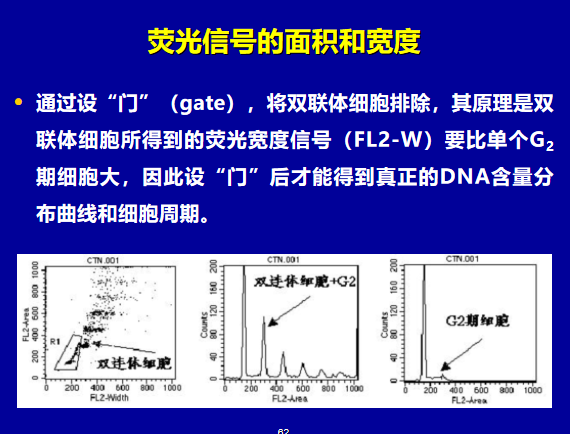
流式细胞术的应用中,自发荧光的高低受什么因素影响?如何提高信噪比?设门的目的是什么?:


-
如何提高分辨率?——要提高分辨率,即减小R值,可采取措施:(1)降低波长λ值,使用短波长光源(2)增大介质n值以提高NA值(NA=n·sinα/2 )(3)增大孔径角α值以提高NA值(4)增加明暗反差(如通过调节相差的相差显微镜——可观察未经染色的标本和活细胞)。
-
亚细胞分离的过程:
- 破碎细胞:培养细胞或组织细胞可以采用渗透压冲击、超声波振荡、机械力研磨或剪切等各种方法来实现。比较温和的破碎程序可以使细胞核、高尔基体、线粒体和其他膜结构保持完整。
- 细胞成分分离:差速离心和密度梯度(由粒子大小、密度、沉降系数决定)离心;若是独特的细胞膜根据表面电荷的密度采用连续流动电泳的方法分离,根据大小采用凝胶过滤、液相多聚物分离或用特异的抗体(免疫亲和捕获)或凝集素免疫吸附的方法进行分离。
-
如何评价亚细胞分离的效果?
- 利用光学或电子显微镜来观察结构
- 检测蛋白质的浓度或合适的标志酶(标志酶的活性可确定目的细胞器的产率)
-
请设计一条外泌体的研究路线:外泌体染料——PKH-67,DiD等
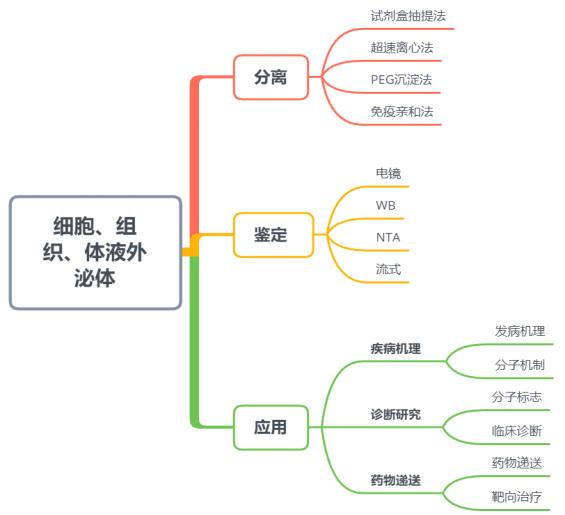
-
所有细胞类型都可以通过调控其内部的代谢途径支持其发挥细胞类型特异性功能,炎症性巨噬细胞的的代谢调控机制是什么?——通过代谢组学和转录组学分析,发现除了已知的有氧糖酵解 (aerobic glycolysis) 代谢产物以及三羧酸循环断裂(broken TCA cycle) 代谢产物琥珀酸(succinate)和亚甲基丁二酸 (itaconate) 迅速累积外,LPS刺激巨噬细胞的糖酵解支路(glycolysis offshoot), 包括:磷酸戊糖途径(PPP)和丝氨酸合成途径 (SSP) ,以及重要的代谢网络丝氨酸/甘氨酸/一碳代谢(serine/glycine/one-carbon, SGOC) 迅速增强。
-
荧光显微镜和普通显微镜有何区别?

-
在荧光显微镜成像时,影响荧光的因素有哪些?

-
荧光样品有哪些制备要求?
- 荧光标记反应的特异性强、荧光信号定位准确,如核定位(Hoechst);
- 保持样品结构应有的结构形态完整性;
- 荧光信号稳定性要好且荧光强度要适宜,太弱不易检出,太强则精细结构不清楚;荧光信号的响应应当准确、灵敏和可重复性;
- 样品图像的背景应当干净,干扰杂质少。
-
激光扫描共聚焦的应用(医学+生物学):
- 原位鉴定细胞或组织内生物大分子、观察细胞及亚细胞形态结构(PI+DAPI+AO【RNA-红;DNA-绿】等——检测核酸)、检测荧光原位杂交信号(FISH)
- 检测细胞凋亡:细胞核皱缩+凋亡小体;检测DNA损伤(彗星实验)
-
细胞凋亡和坏死的区别:

-
原代细胞与细胞系有什么区别?

-
简述每代贴附细胞的生长过程:
- 游离期:细胞接种后在培养液中呈现悬浮状态,也称为悬浮期,此时细胞质回缩,胞体呈圆形
- 贴壁期:细胞附着于底物上,游离期结束。这是促贴壁因子(如胶原)的作用。
- 潜伏期+对数生长期+平台期

-
培养细胞时,细胞液颜色变化分别代表什么?——传统细胞基础培养基是红色的,因为其中含有酚红,弱碱性的酚红呈红色,作为细胞培养pH指示。

-
体外培养肿瘤细胞生物学检测:异体动物(用裸鼠)接种成瘤、软琼脂培养(检测集落形成能力)、核型分析(染色体数量)、细胞骨架和电镜观察、形态观察、生长曲线、癌基因和抑癌基因的检测
-
细胞融合核体细胞杂交有哪些运用?
- 细胞融合:单克隆抗体的制备,核质关系,体细胞的遗传和发育,新品种的培养,免疫作用, 疾病的治疗和性状的改良,潜伏病毒的研究
- 体细胞杂交:

-
细胞克隆的方法以及克隆形成率的影响因素:
- 稀释铺板法:使用稀释后的低密度细胞悬液,在多孔塑料培养板各孔中分别接种细胞悬液,使每孔平均含 1 -2个细胞。
- 饲养层培养法:为了促使刚刚克隆化的极少量细胞生长、繁殖,在培养皿中加入能贴壁生长的其它细胞,称之为“饲养细胞(feeder cell)” 。
- 胶原膜板或血纤维蛋白膜层板克隆法:原代培养细胞容易称附于胶原膜层或血纤维膜层等生长基质成分之上。
- 琼脂克隆法:琼脂层是一种简单的生长基质层,可帮助细胞贴附生长。

-
外源基因在真核细胞内表达的意义是什么?
- 为重组真核基因表达提供一个仿真的环境,利于其表达;
- 利于研究真核细胞内表达产物的生理作用;
- 方便基因治疗;
- 便于纯化大量重组的生物工程药物和疫苗,一般用CHO、293T (HEK) 瞬时表达(这些细胞生长快、转染效率高、蛋白产量高)。
-
**细胞转染技术有哪些类别,他们的区别是什么?
- 瞬时转染:外源表达载体进入转染细胞后,不整合到宿主染色体上,游离存在于染色体外。一般转染后48-72小时是蛋白表达的高峰,一个宿主细胞中可存在多个拷贝数,产生高水平的表达,通常只持续几天。——利于研究蛋白质表达水平和定位。
- 稳定转染:外源基因转染进入受体细胞后,被转染的外源基因整合到染色体中,随细胞分裂而复制,产生稳定或永久转染的细胞系。整合到染色体上的概率小,因此后需要利用流式分选进行筛选。
- 比较:
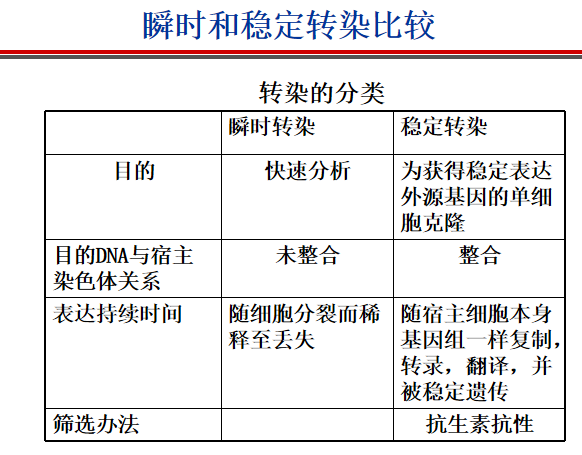
-
细胞转染有哪些方法?
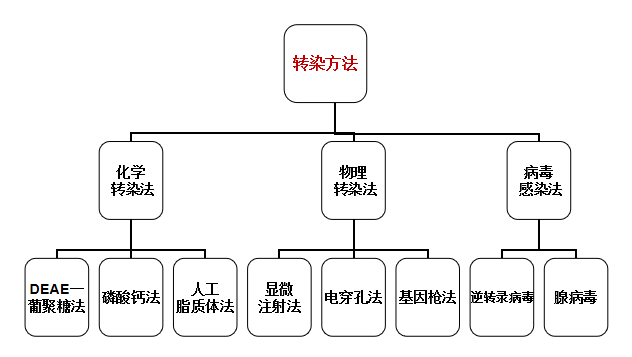
- 物理介导:
- 电穿孔法:靠脉冲电流在细胞膜上打孔(细胞膜变成亲水性)而将核酸导入细胞内。(对细胞损伤大【需要温和的转染试剂】但转染效率高)
- 显微注射:将细胞的某一部分(如细胞核)或外源物质(如外源基因、mRNA、蛋白质等)通过玻璃毛细管拉成的细针,注射到细胞质或细胞核内。(转染效率高,但耗时)
- 基因枪:将遗传物质或其他物质附着于高速微弹直接射入细胞、组织和细胞器的转染方法 ,可以将大分子导入细胞。
- 化学介导:
- 磷酸钙共沉淀:磷酸钙能促进外源DNA与靶细胞表面的结合,磷酸钙-DNA复合物沉淀黏附在细胞膜表面,借助内吞作用进入细胞质。(适合转染哺乳类动物细胞,但转染效率低)
- DEAE-葡聚糖法:DEAE-葡聚糖是阳离子多聚物,它与带负电的核酸结合后接近细胞膜而被摄取,通过 endocytosis(内吞作用) 进入细胞。(价格简单,重复性比磷酸钙好,但毒性大)
- PEI法:聚乙烯亚胺(Polyethylenimine,PEI)是一种具有较高的阳离子电荷密度的有机大分子。【细胞毒性低】
- 脂质体转染:转染效率高,稳定性好
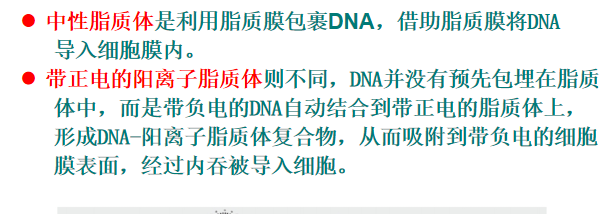 注:如脂质纳米粒(LNP),其包裹RNA容易被抗原呈递细胞吸收,常用于疫苗的开发
注:如脂质纳米粒(LNP),其包裹RNA容易被抗原呈递细胞吸收,常用于疫苗的开发
- 病毒转染:以病毒基因作为载体,通过病毒感染的方式将外源DNA导入到细胞中, 其中以逆转录病毒及腺病毒转染系统最为常用。
- 腺病毒(Adenovirus,AV):用于瞬时转染,在增殖和非增殖细胞中感染和表达基因【其依赖于细胞表面的一种腺病毒受体CAR,很多细胞具有这种受体】——双链DNA病毒
- 腺相关病毒(adeno-associated virus,AAV):基因表达时间长,但不能独立复制,只有在辅助病毒(通常为腺病毒)存在时才能进行复制和溶细胞性感染,否则只能建立溶源性潜伏感染。——单链DNA病毒
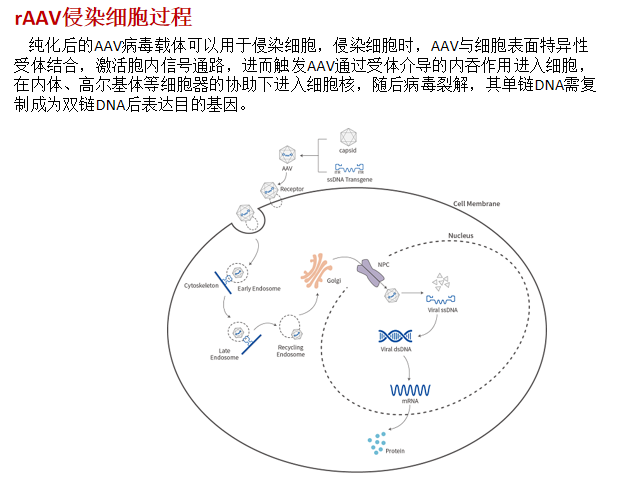
- 逆转录病毒(Retrovirus):RNA病毒,其会把外源基因稳定整合在宿主细胞基因组中。整合的病毒基因可利用宿主细胞的酶自行转录与复制,RNA可合成蛋白,再包装病毒从胞内释放,成为感染性病毒。
 注:稳定、转染率可达100%,但只能整合表达至分裂相的细胞(但慢病毒lentivirus可感染非分裂细胞)
注:稳定、转染率可达100%,但只能整合表达至分裂相的细胞(但慢病毒lentivirus可感染非分裂细胞)
- 物理介导:
-
如何构建稳定的细胞系?
- 抗药的共转染法:同时导入抗药基因,可通过药物筛选去除大量未被转染的细胞,如neo抗性基因抗G418。
- 报告基因的共转染:如把报告基因与目的基因融合,共表达,后续通过流式细胞仪(FACS)进行细胞分选,后培养。
-
生物体内广泛存在的RNAi的生物学意义是什么?
- 病毒防御:i是低等生物和植物抗病毒防御系统的一道防线。
- 基因调控:在染色质层面、RNA编辑和稳定性、翻译水平。
- 应用:推动人类基因组研究、高通量筛选药物靶基因、用于基因治疗、新药开发、生物医学领域。
-
基因编辑有哪些方法?
- 传统的依赖同源重组法:外源DNA序列与靶细胞DNA序列发生同源重组——效率低、周期长
- ZFNs(锌指核酸酶):由决定其特异性的锌指蛋白结构域和切割 DNA 的FokI核酸酶结构域共同组成。每个锌脂蛋白识别一个特异的3bp。——脱靶几率大
- TALEN(类转录激活因子效应物核酸酶):TALEN是人工改造的限制性内切酶(一个TAL效应物识别一个核苷酸),是将TALE的DNA结合域与FokⅠ 的DNA切割域融合而成。——打靶效率较ZFNs高、但获得TALEN质粒较困难。
- CRISPR【间隔序列S——捕获外源基因+重复序列R+cas基因】/cas9【H结构域切割互补链、R结构域切割非互补链】:gRNA引导的Cas9靶向DNA切割和DNA修复两个基本过程,目的DNA含PAM序列(cas9识别),切割在PAM上游的第三个碱基处,切割后对断裂的双链DNA进行同源重组修复或者非同源末端接合,这可完成基因组特定区域InDel突变、敲入、多位点同时突变和小片段的删失等。——可同时打靶多个位点、更高效便捷。
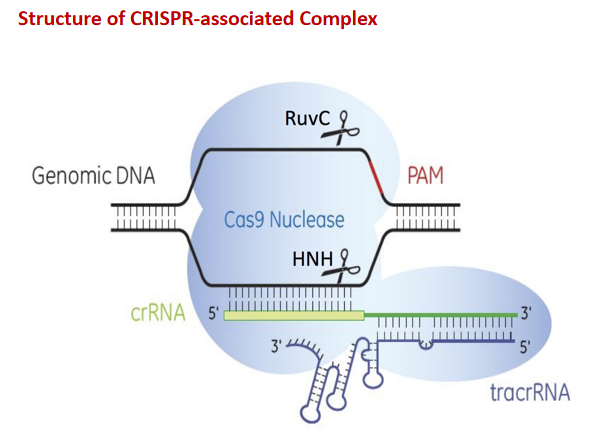 注:tracrRNA和pre-crRNA通过碱基配对作用结合,经过RNaseIII(核糖核酸内切酶Dicer)修剪,并与Cas9结合,成为具有DNA切割能力的复合体。
注:tracrRNA和pre-crRNA通过碱基配对作用结合,经过RNaseIII(核糖核酸内切酶Dicer)修剪,并与Cas9结合,成为具有DNA切割能力的复合体。
-
CRISPR/Cas9系统有哪些应用?
- 基因抑制或激活:dcas9——Cas9(dCas9)的C端加上KRAB等具有抑制活性的结构域,特异性抑制目标基因表达(CRISPRi)
- 表观修饰调控:加上具有染色质修饰的效应子,进行甲基化等修饰
- DNA碱基修饰:嘧啶碱基转换技术,失活cas9,与胞苷脱氨酶AID融合,AID可直接催化C转换U
- 衍生RNA编辑——CRISPR-cas13实现在RNA水平上的单碱基编辑。
-
细胞高内涵筛选体系建立的原则

-
激光共聚焦显微镜能提高分辨率吗?为什么? ——可以

-
显微荧光数码图像的质量是由什么决定的?并分别简述之
- 分辨率:决定因素是CCD相机的选择和图像收集设置。分辨率用于阐述显微镜观察像时,分辨两点的最小距离,分辨的距离越小,显微镜的质量越高,分辨率越高。显微镜的分辨率取决于光学元件的数值孔径(NA),以及观察样本的波长。高NA的物镜可以吸收更多来自样品的发射光,利于产生分辨率更高的图像。
- 信噪比(SNR):指接收到有用信号的强度与接收到干扰信号的强度的比值。干扰信号可能来自试样或载玻片等表面的凹凸起伏,也可能来自样品中的杂质。此外,CCD相机入射电子束流含有来自电子源的发射噪声,放大电路中的各种电子元器件带来的热噪声等。
- 此外,还和样品的荧光强度、显微镜的光学系统和滤光系统有关。
-
什么是荧光蛋白生物感应器?——利用荧光蛋白作为生物分子检测的工具的装置或系统
-
基因编辑在细胞生物学研究中用途:

-
CRISPRi和RNAi的异同?
