s# 大脑的基本结构
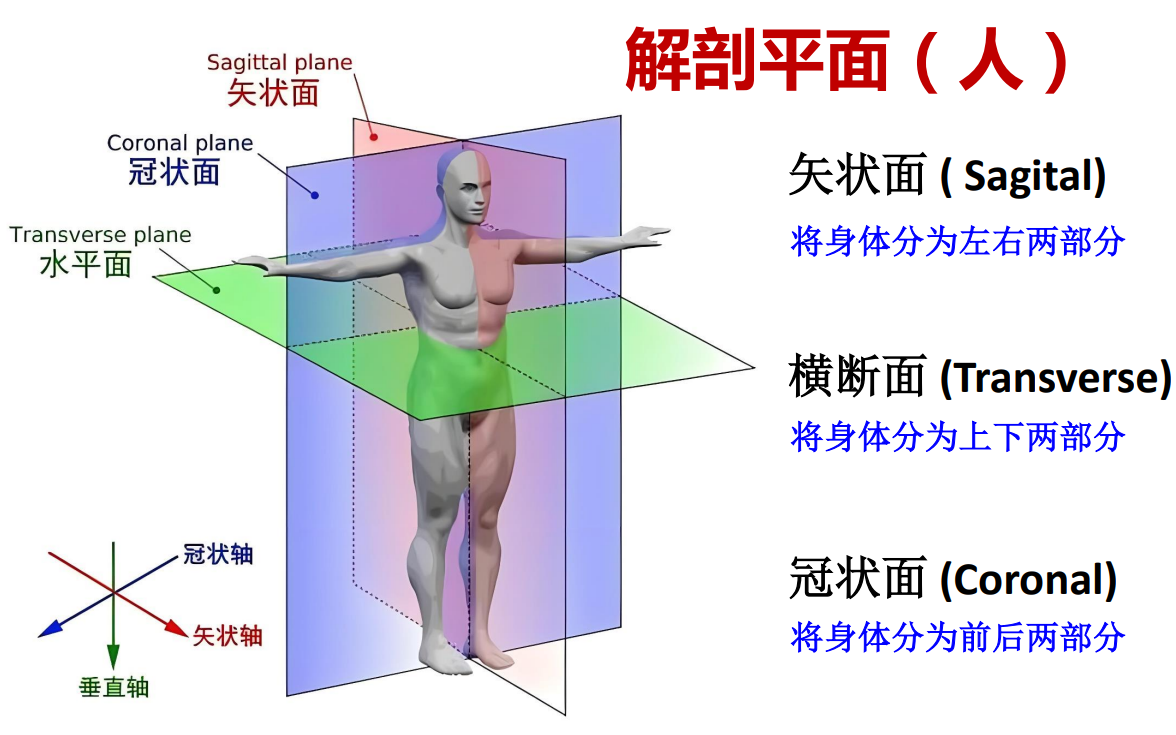
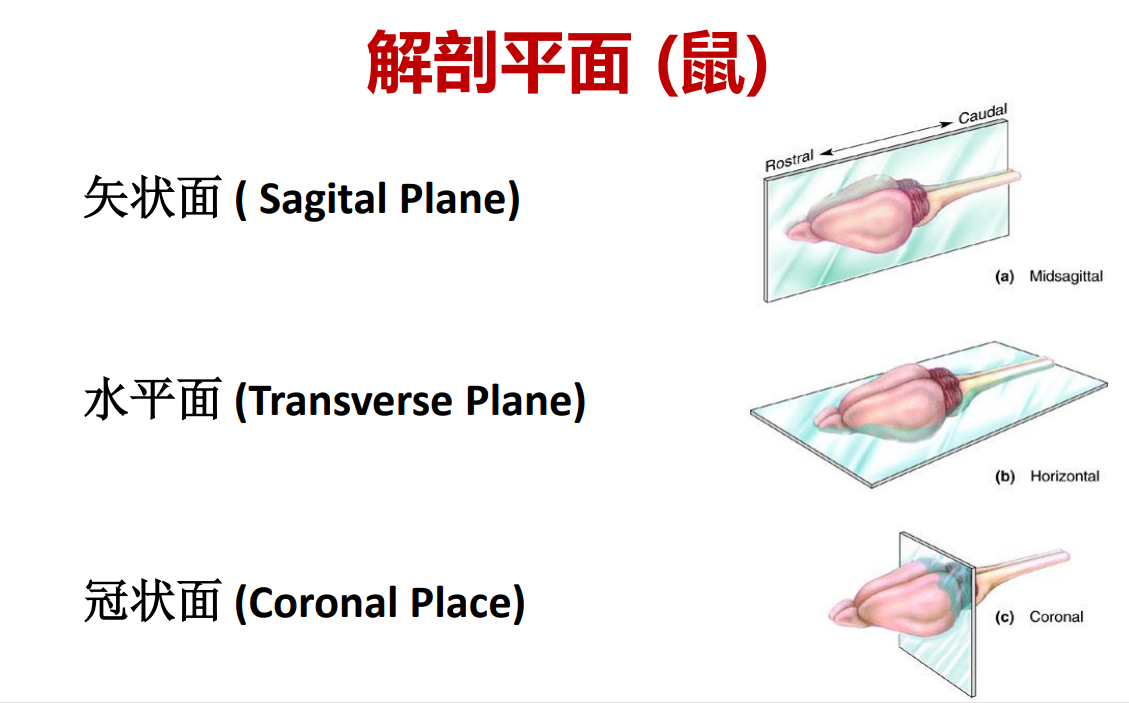
- 解剖平面:矢状面、冠状面、横断面【人】;矢状面、水平面、冠状面【鼠】
- 大脑分区
- 结构:包含五个叶:额叶、顶叶、枕叶、颞叶、岛叶【藏于额叶和颞叶里】
- 功能分区
- 运动皮层(中央沟的前面):脑机接口
- 感觉皮层(中央沟的后面)
- 神经细胞的电位
- 动作电位:宽度1-2ms,传递时间2-4ms,因此当两个动作电位时长超过8ms时,存在多突触的可能性。
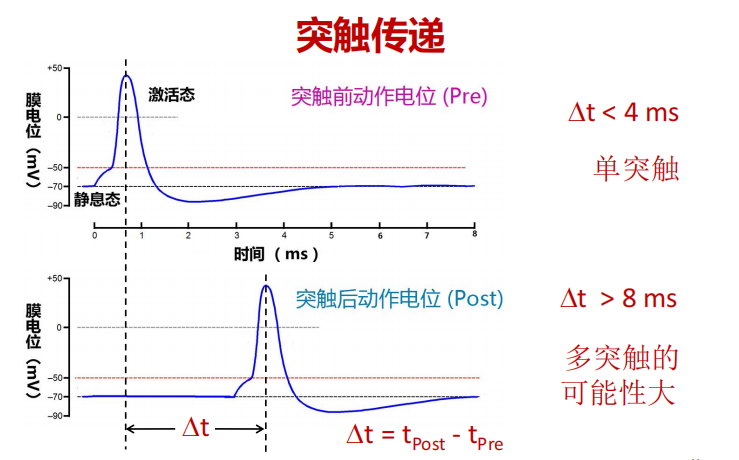
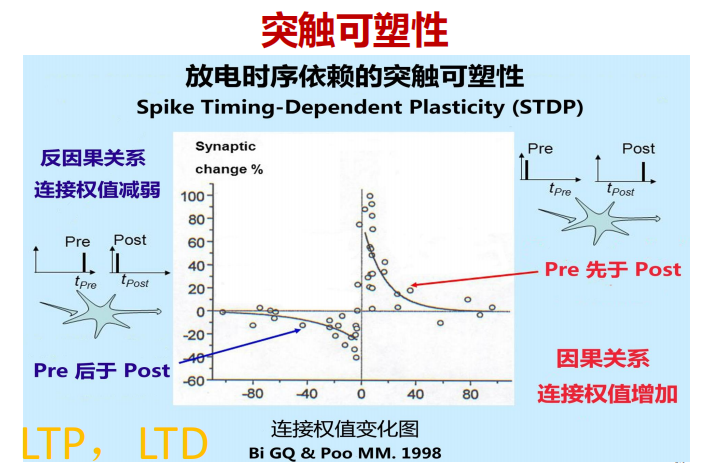
- 突触可塑性:
- PPR(Paired Pulse Ratio——测突触前细胞的可塑性)——验证突触前递质释放概率变化的电生理指标——【PPR越大,突触前神经元释放递质的概率低】;
- STDP(放电时间依赖的突触可塑性):高频刺激/药物(内啡肽)后测突触后的可塑性(LTP+LTD)。
- 动作电位:宽度1-2ms,传递时间2-4ms,因此当两个动作电位时长超过8ms时,存在多突触的可能性。
- 神经细胞电突触的测试:生物素的双向扩散+A、B细胞的互相兴奋+兴奋传递更快无突触延迟
神经样品的制备及培养
体外培养:
- cell culture :原代培养(神经细胞:10-20days)+传代培养(癌细胞)
- 组织培养:Brian slice——保留了脑区A与B的连接关系
- 器官培养
- 类器官培养:脑的类器官(Brian organoid)
单细胞电生理与多通道记录
- 单细胞电生理技术:
- 细胞内记录:细胞外为参考电极,测的是细胞内与细胞外的电势差【 不应期:离子通道开放一段时间后,会关闭,不会一直开(轴丘产生的动作电位不能立刻往回走)】
- [孙坚元——膜片钳#^7d5cca|膜片钳技术]



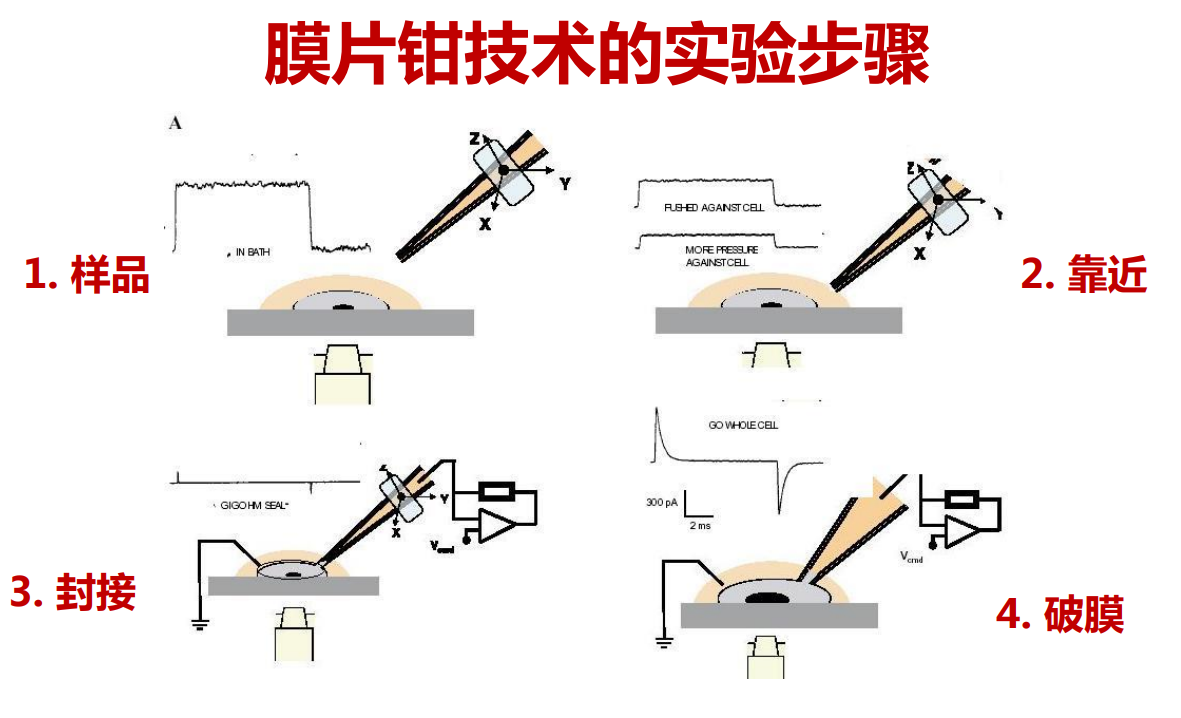 注:封接质量与是否存在漏电流有关
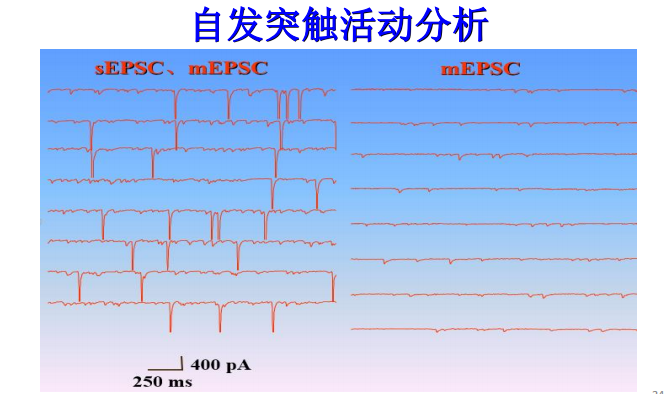
1. 自发突触活动分析:
注:封接质量与是否存在漏电流有关
1. 自发突触活动分析: **
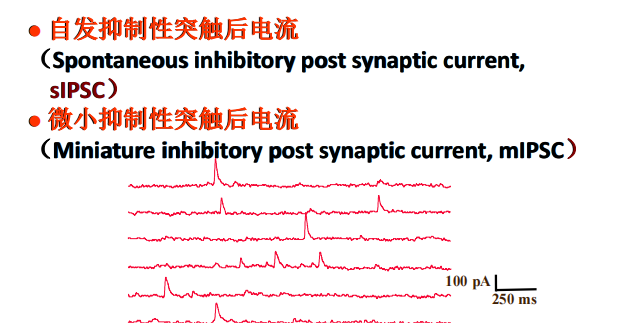
** 注:mEPSC——无动作电位,上一级细胞突触囊泡的自发释放(谷氨酸兴奋性电流朝下走【阳离子内流,电流方向往内】,反之Gaba为抑制性神经元向上走);sEPSC——是突触前膜由自发动作电位诱发的Glu释放而引起的突触后膜反应。
注:mEPSC——无动作电位,上一级细胞突触囊泡的自发释放(谷氨酸兴奋性电流朝下走【阳离子内流,电流方向往内】,反之Gaba为抑制性神经元向上走);sEPSC——是突触前膜由自发动作电位诱发的Glu释放而引起的突触后膜反应。
 2. 神经元可兴奋性:膜片钳钳住细胞【电流不变】,用相同强度的脉冲电流刺激,看spike数的多少(LTP、药物都可能会使细胞的兴奋性增加)
3. 双膜片钳技术——看突触前神经元与哪个突触后神经元的连接更紧密
2. 神经元可兴奋性:膜片钳钳住细胞【电流不变】,用相同强度的脉冲电流刺激,看spike数的多少(LTP、药物都可能会使细胞的兴奋性增加)
3. 双膜片钳技术——看突触前神经元与哪个突触后神经元的连接更紧密 - 样品:原代神经培养(三角形-锥型,圆形-兴奋性谷氨酸) 、脑片培养、在体记录
多通道电极记录技术
- 细胞外记录——Cell attach(金属丝靠近细胞),只可测单个细胞的动作电位和集中多个细胞的场电位
- MEA(微电极阵列):表面信号的探测——如视网膜刺激的探测
- Microwire Array(微丝阵列):电极间距400um对细胞密度不高的,100-200对密度高的——一开始插电极的深度可以稍微不足,后续可调整突破免疫反应产生的结痂到达指导深度;
- Utah Array(犹他阵列):只有针尖可导电;
- 柔性基底电极
- 硅基电极阵列
- 多电极技术【探索与行为相关的神经元】
- 四电极分离:神经元到四个电极的强度比例——辨别神经元放电时的身份,通过波形、波宽和拖尾也可区别神经元,比如Gaba、锥体神经元较宽,较窄且频率高的为中间神经元【滤波器要滤到300hz以下的,2ms的波宽代表500hz】

- 单/双神经元放电间隔分析(ISI):放电是否规律(单)、分析两个神经元的相互关系(上下级、同步放电)——互相关分析

- 局部场电位分析:根据波形分(如α、γ等)一群细胞的状态,监控睡眠状态(如睡着有ripple涟漪)
- 四电极分离:神经元到四个电极的强度比例——辨别神经元放电时的身份,通过波形、波宽和拖尾也可区别神经元,比如Gaba、锥体神经元较宽,较窄且频率高的为中间神经元【滤波器要滤到300hz以下的,2ms的波宽代表500hz】
组装体(同学)
- 流程:获得聚集小球体——诱导因子诱导成不同皮层细胞(免疫组化验证)——两类小球放在一块组装(细胞的自组装)
- 形态学检测:组装后进行荧光标记或者逆行病毒标记失踪(两个细胞标记不同的荧光)看组装是否成功(共定位)以及投射情况(免疫组化来看投射细胞的类型)
- 功能检测:光遗传相关蛋白在上游激活后,检测下游的钙活动+膜片钳(光激活上游,检测下游电信号)
- 组装体——神经发育障碍组装体的效果不太好,钙信号活动弱、肌肉收缩的调控+组装体移植到小鼠中进行药物检验
脑机接口
- 编码理论:专一线路+群体编码——建立神经集群放电和运动意图【此为运动型,除外还有感觉型(助听器等)】的映射关系
- 脑机接口:记录运动皮层的信号,并解码
- 脑控:脑控制机器
- 控脑:RAM(记忆修复和增强)
- 高精准护脑
- 硬件分类:

- 非植入式:EEG脑电图(场电位)
- 半植入式:ECoG(皮层电位)
- 全植入式:Spike LFP动作电位(场电位)
- 单通道【如脑电波比赛】:耳垂为参考电极、从额叶收集脑电波【α波清醒、β波兴奋、σ波睡眠】——分析局部场电位波的比例来看谁注意力集中
- 非侵入式电极:
- 被动:
- SSVEP(稳态视觉诱发电位):频率较高的刺激——被动接收信号,从而反馈信号,如用目光进行电脑打字
- P300(事件相关电位ERP):不同形状组合的刺激
- 主动:MI(运动想象)——存在运动意图就行,如运动想象驾驶
- 被动:
- 侵入式:薄膜电极(记录皮层电位)、犹他电极(记录深层的放电信号)
- 【光学双向脑机接口-2024.4.16】在体神经活动的光学检测与调控——孔令杰(清华大学精密仪器系):
- 神经光子学
- 研究意义【认识脑—感知认知、保护脑—疾病诊治、模拟脑(人脑15瓦就可完成计算)—人工智能(耗能巨大)】
- 双向脑机接口:允许脑和外部设备间的双向信息交换【单向:只能接收脑传来的命令或发送信号到脑】
- 脑机接口的实现:电生理技术【膜片钳——电极阵列】/影像技术【fMRI+fNIRS】/光学显微技术【Gcamp/电压敏感蛋白】——读+写——脑机接口
- 视觉信息往往整合到大脑皮层的IV层
- 光学显微技术:高空间分辨率+特定基因型神经元活动的观测与调控——如基于钙信号成像的运动信息解码 1. 高速三维成像【光学相位锁定超声透镜】:机械惯性限制扫描速度——因此采用无惯性约束方法【高速调制波前离焦度】 2. 深层组织成像【多面棱镜——MPAO(多入瞳自适应光学,做到不同区域的独立补偿)】:自适应光学(对组织各向异性的调制和预补偿) 3. 宽视场、高分辨、高通量成像【宽视场物镜+高通量相机阵列】:往往高分辨视场较小——RUSH系统(相机阵列并行采集) 4. 大尺度、高分辨、层析成像?——RA-WiFi mesoscope【随机快速跳扫切换(利用振镜切换)】——实现对感兴趣的区域的灵活切换,后进行扫描 5. 光场成像:SWIFT(从二维到三维)
- 控脑:
- 全息+双光子光遗传——单细胞分辨率的选择性光激活
- 消除像差影响(SAC-NOVO)——避免误激发
- 提高轴向分辨率——(圆环形/圆盘形激发)散斑会降低激活效率——珠链形图案
- 解析神经功能联结:功能柱内跨层神经环路解析
- 护脑
- 脑状态检测(如大脑的不同状态下受神经调制的影响)——生理生化参数传感【区分不同神经递质——Plug-and-play(即插即用,不受限动物模型、器官类型)】
- 精准癌症预后:活检样本经过光学显微镜成像后被记录为超大像素数字病理图像,供医生诊断【用归因热图给出高贡献区域的空间位置信息】——智能病理【基于医学先验信息,利用深度学习发掘模型PathFinder】
神经递质与调质的检测技术
- 神经递质(无旁突触分泌,只有神经调质【胶质细胞也可以释放】有)

- 腺苷——与睡眠有关,因为此时ATP消耗过多会产生腺苷
- 乙酰胆碱:神经肌肉接头
- 多巴胺:愉悦
- GABA:抑制性,谷氨酸:兴奋性
- 检测:
- HPLC技术:保留时间法【不同物质在色谱柱的保留时间不同,更具峰值可以定量】+微透析技术在体取样【活体监控】——检测多巴胺
- 质谱方法【可定性和定量】:根据质荷比——使试样中各组分在离子源中发生电离,生成不同荷质比的带电荷的离子,经加速电场的作用,形成离子束,进入质量分析器,后记录飞行时间。
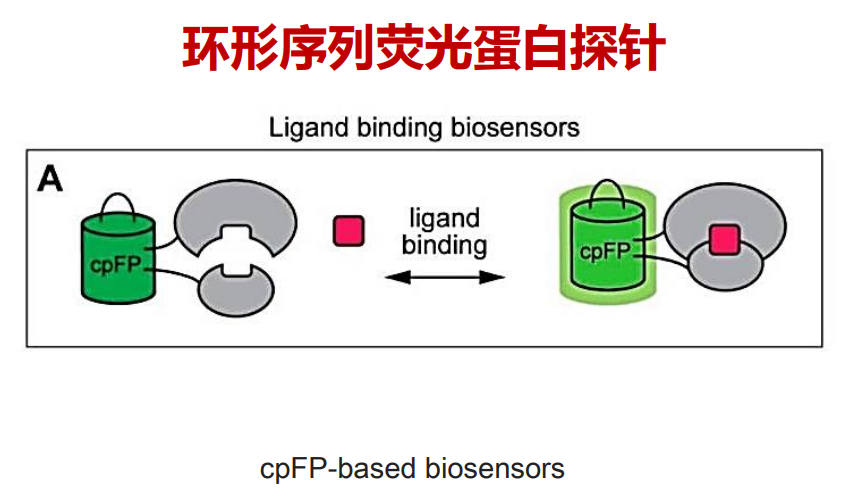
- 荧光蛋白探针检测方法【受体结合看相对强度或者绝对强度的变化】:钙成像、谷氨酸能【iGluSnFR】、多巴胺能神经元的检测
- 电化学方法检测:
- 碳纤电极(用玻璃包裹的碳纤维管):施加电压氧化神经递质,用碳来记录氧化还原过程(不会产生气泡),伴随电压升高,探测在某个电压的情况下所产生的特殊的神经递质。
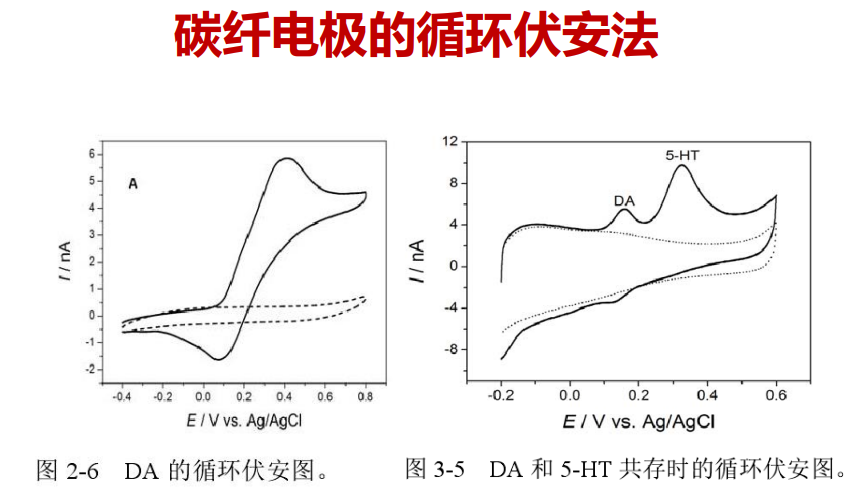 注:伏安法给的是变化的电压,不同的神经递质在不同的电压下发生氧化还原反应,并产生相对应的电流。
注:伏安法给的是变化的电压,不同的神经递质在不同的电压下发生氧化还原反应,并产生相对应的电流。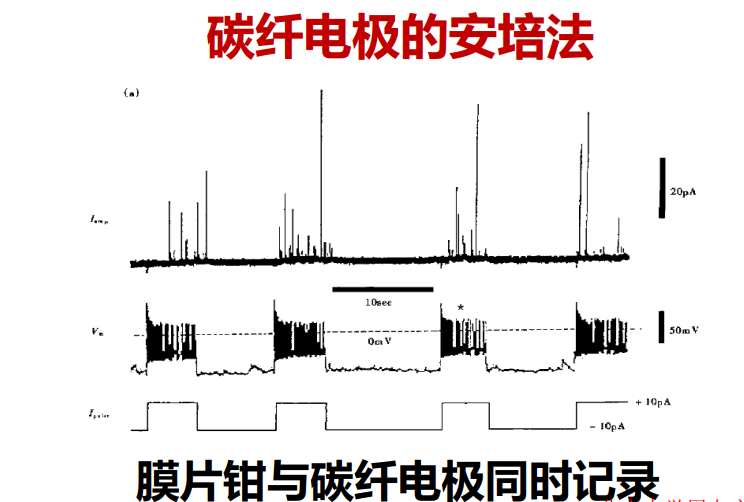 特点:安培法给的是固定的电压,需要保持该电压高于被检测神经递质的氧化还原电位。特点灵敏,但无法分别儿茶酚胺类的神经递质,他们的氧化还原电位是一致的
特点:安培法给的是固定的电压,需要保持该电压高于被检测神经递质的氧化还原电位。特点灵敏,但无法分别儿茶酚胺类的神经递质,他们的氧化还原电位是一致的 - 电化学生物传感器:【活体细胞的检测——in vitro】受体与配体结合产生特殊的电流
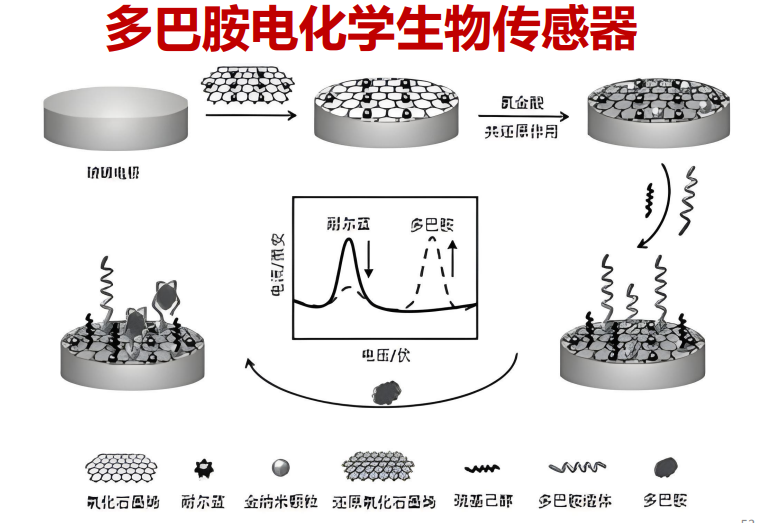

- 碳纤电极(用玻璃包裹的碳纤维管):施加电压氧化神经递质,用碳来记录氧化还原过程(不会产生气泡),伴随电压升高,探测在某个电压的情况下所产生的特殊的神经递质。
发声行为的机制(同学)
- 葡聚糖螯合荧光分子可结合膜蛋白【无特异性】——形态学上PAG-HVC的投射
- 四电极分离技术检测——PAG:高级发声中枢【需排除潜在脑区尾中丘】
- 神经递质DA的检测,看PAG发挥功能的原因——抑制多巴胺能神经元,6-OHDA特异阻断多巴胺能神经元的功能
- 光遗传验证:在没有大鸟存在的情况,刺激PAG,看小鸟是否模仿
- 特意标记用病毒示踪注射【根据启动子来特异表达】——成年鼠注射2周后病毒表达比较明显
耳蜗毛细胞的机械电转导—TMHS(同学)
- TMHS缺陷会导致听力障碍
- 形态学:TMHS缺乏影响毛细胞的形态(原位杂交+电镜)
- 相互作用:免疫共沉淀——TMHS+PCDH15
- 电生理验证TMHS与通道蛋白的关系
化学遗传学调控脑活动
- 神经环路:解析需要解析清楚什么? 刺激——Transimission(传递)——转化——Interpretation(解释)
- 任务相关神经元
- 单细胞水平
- 上下游
- 神经环路编码信息的主要方式:
- Rate coding:如声音频率,由响应不同赫兹的神经元进行编码
- Temporal coding:事件的先后——时间相关
- Population coding:群体
- FFN(feedforward network前馈网络):信息一直往前传,会造成同步化;连接密度和连接强度是该网络的关键
- 模式动物
- 线虫:302个神经元
- 果蝇:1w
- 斑马鱼:10w
- 小鼠:600w
- 猴子:10亿
- 人:860亿
- 解决层次
- 解刨学
- 功能检测
- 行为学分析
- 神经环路与动物行为的关系:相关性(A变B也变,但不能证明因果性) 和 因果性(充分性【增强A,B也会被增强——gain of function】、必要性【没有A,B就不能发生——loss of function】)
- 证明:
- 生理条件下,行为发生时该环路被激活
- Gain of function
- Loss of function
- 建立计算模型:如视觉神经环路代表的深度卷积神经网络
- 化学遗传学:在体原位调节【靶点:化学门控的离子通道——GPCR】神经元活动

- 化学门控靶点受体:GPCR——Gαs激活基因表达(慢),Gαq通过引起Ca离子释放激活神经元(快)【胞浆浓度umol,内质网和胞外mmol】;Gαi起抑制神经元的效果【乙酰胆碱可以激活M(GPCR)+N型(离子通道)】

- M型毒蕈碱型受体:
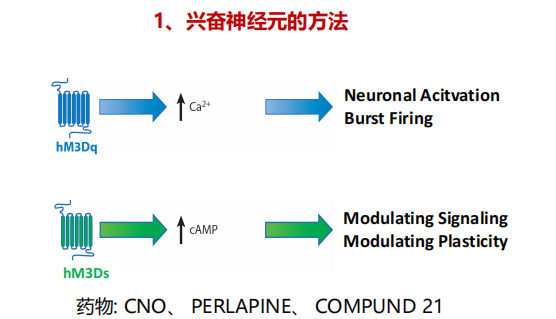
- DREADDS技术——hM系列【设计的受体对内源的分子不反应,设计的分子对内源的受体不反应】——CNO不结合内源乙酰胆碱受体,只结合突变的受体hM3Dq(相较于hM3【Gq-coupled】需要更高的浓度),然后激活神经元(快速);hM3Ds特异激活胰岛β细胞(缓慢释放);hM4Di,抑制神经元的活性。
- SALB+KORDi【Gi-coupled receptor】可以抑制神经元活性
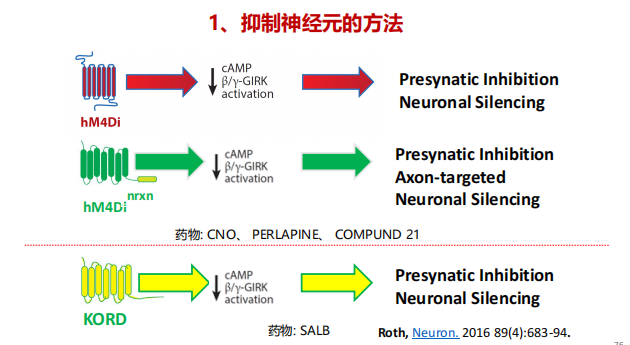
- 特点:CNO可以同时激活和抑制两类细胞,分析上下游【跨突触受体】,但CNO无法通过血脑屏障,发挥作用的是它的代谢物,而CNO的代谢物也可能会影响神经系统,可用新设计的分子替代

- Cre-Loxp:标记神经元
- DREADDS技术——hM系列【设计的受体对内源的分子不反应,设计的分子对内源的受体不反应】——CNO不结合内源乙酰胆碱受体,只结合突变的受体hM3Dq(相较于hM3【Gq-coupled】需要更高的浓度),然后激活神经元(快速);hM3Ds特异激活胰岛β细胞(缓慢释放);hM4Di,抑制神经元的活性。
- N受体(乙酰胆碱受体):LGIC——药物堵住离子通道,结合位点突变后结合特殊的分子,如PSAM
- M型毒蕈碱型受体:
- 关于遗传学的问题:
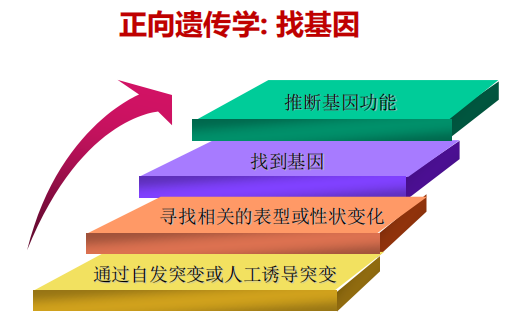
- 正向遗传学
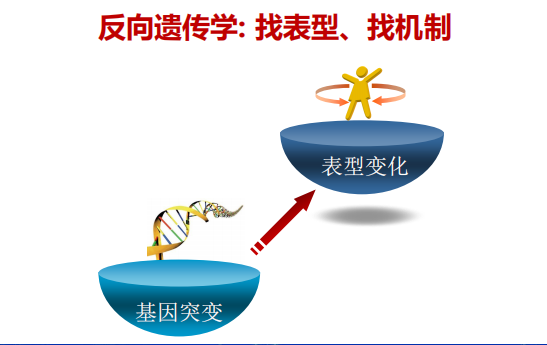
- 反向遗传学:基因对表型的影响
- 正向遗传学
- 化学门控靶点受体:GPCR——Gαs激活基因表达(慢),Gαq通过引起Ca离子释放激活神经元(快)【胞浆浓度umol,内质网和胞外mmol】;Gαi起抑制神经元的效果【乙酰胆碱可以激活M(GPCR)+N型(离子通道)】
光遗传学
-
常用的工具:ChR2(激活—激发用500-600,因为488也会激活GFP)、NpHR(抑制)
-
fMRI(/光遗传刺激)+光遗传学——激活大范围内的神经元;Optrode光电极【通过光光电极不同区域的发光,从而激活不同的神经元】
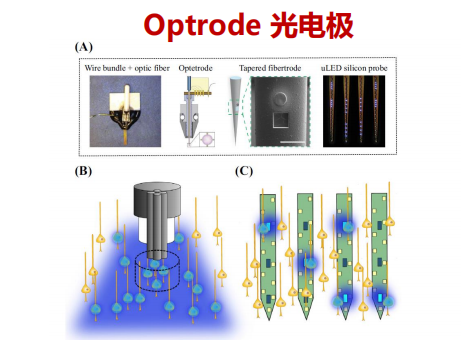
-
激光点阵扫描可精确激活单个神经元
-
应用:
- 解析神经环路——(2)标记B的胞体【依赖A的重组系统传送到B,B的opsin才会表达】,照射A的末梢 or 标记末梢,照射胞体
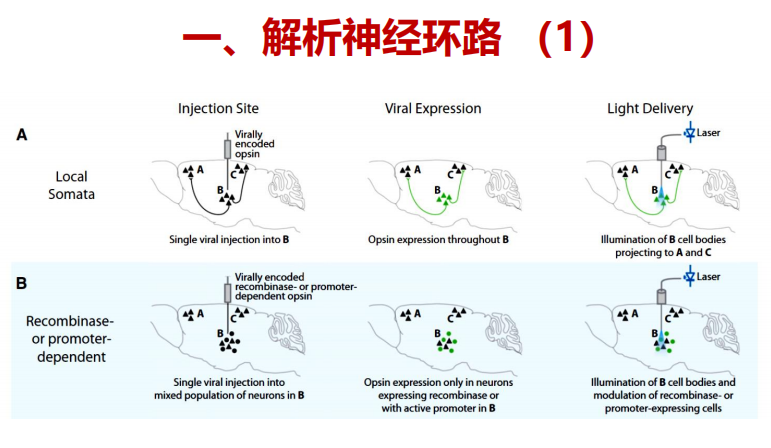 注:A:通过在靶区注射病毒,然后在注射区上方注射一个光传递装置,直接刺激神经元细胞体是可以实现的。即使是这个简单的实验,也可以提供对不会转导传入轴突和传代纤维的病毒的特异性;B:额外的细胞类型特异性是通过病毒载体中的细胞类型特异性启动子或通过重组酶依赖的病毒获得的,注射到特定细胞中表达重组酶如Cre的转基因动物中,导致转基因仅在特定的细胞类型中特异性表达。
注:A:通过在靶区注射病毒,然后在注射区上方注射一个光传递装置,直接刺激神经元细胞体是可以实现的。即使是这个简单的实验,也可以提供对不会转导传入轴突和传代纤维的病毒的特异性;B:额外的细胞类型特异性是通过病毒载体中的细胞类型特异性启动子或通过重组酶依赖的病毒获得的,注射到特定细胞中表达重组酶如Cre的转基因动物中,导致转基因仅在特定的细胞类型中特异性表达。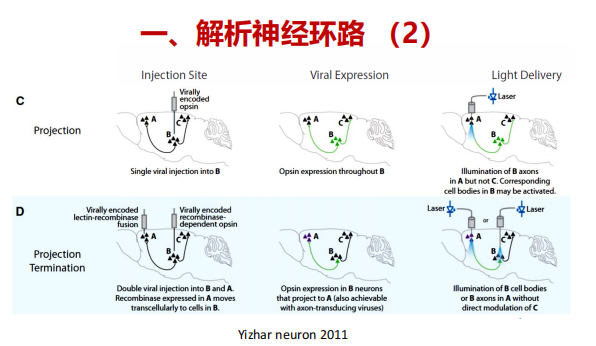 注:C:投射(轴突)靶向是通过在包含细胞体的区域注射病毒来实现的,然后在包含来自病毒转导区域的神经元过程的目标区域上方植入一个光传递装置;通过这种方式,细胞类型通过它们的投射而被靶向。D:投射终止标记是一种更精细的投射靶向版本,其中细胞通过与目标区域的突触连接作为目标,很可能排除轴突仅仅通过该区域的细胞。 跨细胞标记使用一个重组酶依赖的系统显示。表达Cre的病毒与跨神经元示踪剂(凝集素)融合,在突触靶点传递,而一种Cre依赖的病毒被注射到具有细胞体的区域。投射到cre注射区的细胞表达cre依赖的病毒并变得对光敏感。这也可以通过轴突末端转导病毒来实现,尽管不控制突触后细胞类型。
注:C:投射(轴突)靶向是通过在包含细胞体的区域注射病毒来实现的,然后在包含来自病毒转导区域的神经元过程的目标区域上方植入一个光传递装置;通过这种方式,细胞类型通过它们的投射而被靶向。D:投射终止标记是一种更精细的投射靶向版本,其中细胞通过与目标区域的突触连接作为目标,很可能排除轴突仅仅通过该区域的细胞。 跨细胞标记使用一个重组酶依赖的系统显示。表达Cre的病毒与跨神经元示踪剂(凝集素)融合,在突触靶点传递,而一种Cre依赖的病毒被注射到具有细胞体的区域。投射到cre注射区的细胞表达cre依赖的病毒并变得对光敏感。这也可以通过轴突末端转导病毒来实现,尽管不控制突触后细胞类型。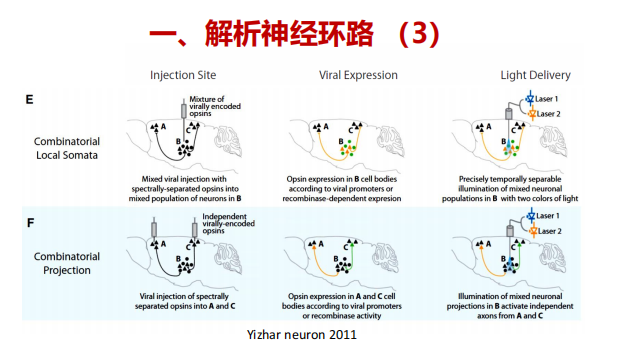 注:E:使用启动子或基于cre的方法的组合,在一个脑区表达两种具有不同特征的视蛋白。光传递到躯体使用两种不同的波长,以减少交叉激活。F:来自两个不同大脑区域的投射被两个波长与上游表达的视蛋白相匹配的不同刺激。
注:E:使用启动子或基于cre的方法的组合,在一个脑区表达两种具有不同特征的视蛋白。光传递到躯体使用两种不同的波长,以减少交叉激活。F:来自两个不同大脑区域的投射被两个波长与上游表达的视蛋白相匹配的不同刺激。
- 疾病治疗:如成瘾治疗、光遗传学治疗视力障碍、借助光束恢复听力
- 解析神经环路——(2)标记B的胞体【依赖A的重组系统传送到B,B的opsin才会表达】,照射A的末梢 or 标记末梢,照射胞体
-
步骤:
- 选择合适的光激活蛋白:

- 激活型:如Chrimson(红光波长最大)、ChR(CoChR—电流最大)
- 抑制型
- 脑区或细胞特异表达的光激活蛋白:

- 光源及控制器的选择

- 光刺激方案:记录光纤长度以及光强度还有插入的位点。
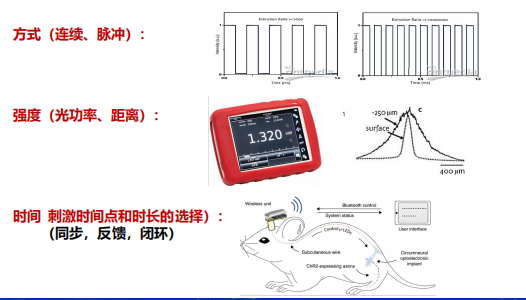
- 光刺激的效果记录
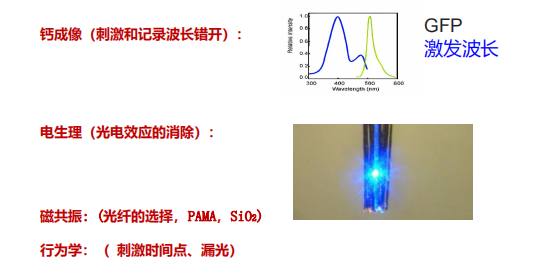
- 选择合适的光激活蛋白:
-
光遗传学与恐惧:
- 讲文献时——关键脑区得搞清楚
- oHFS:为什么在激活有一定表型的时候,抑制神经元没有相反的表型?——高频抑制?光遗传的高频刺激末梢,在突触水平上研究突触后的情况【100hz光遗传学不用,最高就10hz左右】抑制了突触反应,即释放的情况——【可塑性】