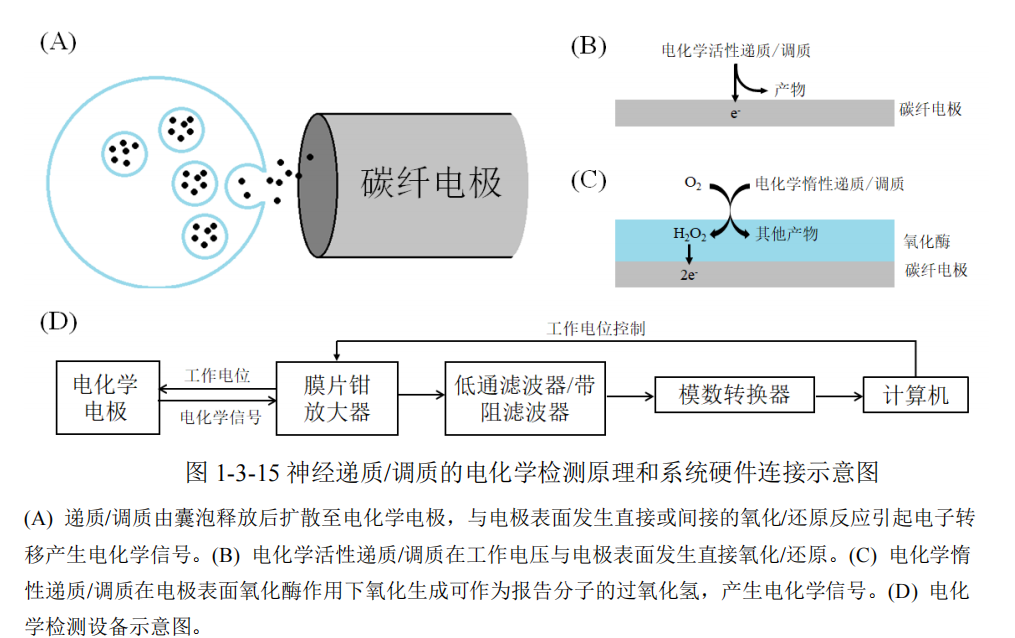
检测神经元的电活动——看突触活动(突触后电流;突触前的钙离子活动;检测膜电容看囊泡活动;囊泡的循环)和动作电位本身【膜片钳】 膜片钳和光遗传的不同:光遗传有额外的离子进入——Na、K、Ca
Patch clamp
- 类别
- Cell-attach:记录单个囊泡的膜融合和回收
- Excised patch:记录单通道的活动【ouside-out,看细胞受体和配体的结合】
- Whole cell patch:整个细胞可能存在活性,记录细胞的电容和电阻
- Perforated patch:用药处理打孔后,只能让一价离子过细胞膜
- 仪器:
- 放大器【software:PatchMaster】:把皮安级别的电信号放大【一般指单个离子通道的信号】——存在补偿电容变化【补偿细胞膜电容的充电放电,加一个虚拟电容】的加压器(capacity compasation)、serious resistence compensation【电极和细胞膜存在电阻,从而导致电压差——二者之间的电流非恒定也在变,注入一个正反馈的自举电流进行补偿】

- 循环泵:人工脑脊液+氧气——记录脑片
- 电极:需要氯化【包括接地的部分也需要】,要不然会产生氧化还原反应,产生电流
- 细胞外液参数:电压钳【电极内液Cs】、电流钳【K】
- 放大器【software:PatchMaster】:把皮安级别的电信号放大【一般指单个离子通道的信号】——存在补偿电容变化【补偿细胞膜电容的充电放电,加一个虚拟电容】的加压器(capacity compasation)、serious resistence compensation【电极和细胞膜存在电阻,从而导致电压差——二者之间的电流非恒定也在变,注入一个正反馈的自举电流进行补偿】
- 如何记录?如何判断哪个离子介导的电流变化?(注入平衡电压时,电流为0)
- 电压钳:可以固定potential【动作电位来,电压变——Na离子流入多少,注入多少负电流,相当于抵消Na离子内流带来的正电;反之也可以注入正向电流】,测量current;注入电压时,电流为0,此时为静息电位。

- 电流钳【静息电位、突触后电位、动作电位】:记录神经元的活性,inject + current来引起动作电位——通过时间的快慢来看刺激强度;inject 0 current,记录电压。

- 动态钳【电阻钳、电导钳】:控制conduatance,测电流or电压
- 电压钳:可以固定potential【动作电位来,电压变——Na离子流入多少,注入多少负电流,相当于抵消Na离子内流带来的正电;反之也可以注入正向电流】,测量current;注入电压时,电流为0,此时为静息电位。
- 记录常见问题
- 阻断其他离子通道和电容来测量某一单一离子通道的电流和电容【补偿】
- 阻断剂不够怎么办?加了药和不加药后做减法
- Liquid juction
- 膜片钳能干什么?
1. whole cell——膜电容+电阻
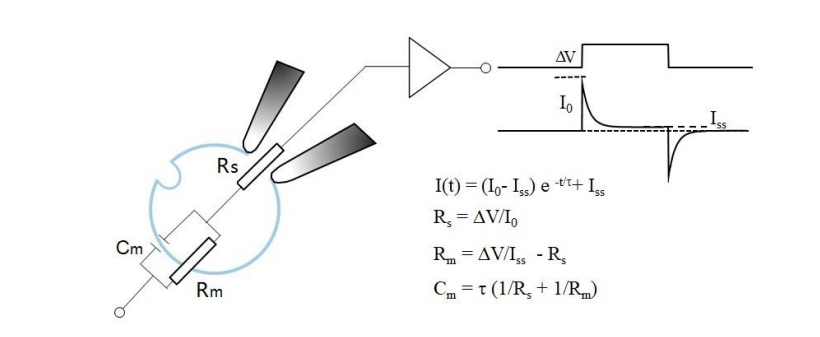 2. Perforated patch
2. Perforated patch
Measurement
- 钙离子通道【电压依赖离子通道】记录current:阻断TEA【K】、TTX【Na】——记录欧姆定律【n个阈下信号加在一起等于一个大信号——线性可加后做leak subtraction——一个大信号减去所有阈下信号之后代表的本征】通过LS,得到通道的本征电流
 注: 尾电流【tail current】:当v变时,Channel没有完全关上——gating和Nest方程的差值,导致电和化学的驱动力变大。
注: 尾电流【tail current】:当v变时,Channel没有完全关上——gating和Nest方程的差值,导致电和化学的驱动力变大。
- 动作电位产生时,Ca离子内流了多少?——根据动作电位用计算机产生waveform,后把这个动态变化的电压注入细胞——因为leak subtraction,实验只记录了钙离子内流【屏蔽其他离子通道】,当产生tail current时【推化学驱动力——推离子浓度差】,钙离子的驱动力最大。

- 突触【ligand gating】:
- 突触前:Cm=Cm+▲C【囊泡融合时,测膜电容——大幅度的变化才可测——可根据实部和虚部把膜电容测出】
- Ca离子的电流
- 单个囊泡释放的膜电容+单个囊泡释放后的电导——cell attach
- 两个细胞的联系:dynamic clamp——存在突触【配体门控】
- 按照电导读出电压决定给定的电流——电压变又重新给【相当于安装了可变的电导器,模拟了突触】
- 电化学:囊泡释放递质产生氧化还原反应——测释放多少神经递质